"Клинические рекомендации "Идиопатический легочный фиброз"
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ
ИДИОПАТИЧЕСКИЙ ЛЕГОЧНЫЙ ФИБРОЗ
Кодирование по Международной статистической классификации болезней и проблем, связанных со здоровьем: J84.1
Год утверждения (частота пересмотра): 2021
Возрастная категория: Взрослые
Год окончания действия: 2023
ID: 677
Разработчик клинической рекомендации
- Российское респираторное общество
Одобрено Научно-практическим Советом Минздрава РФ
Список сокращений
ИЗЛ - интерстициальные заболевания легких
ИИП - идиопатические интерстициальные пневмонии
ИЛФ - идиопатический легочный фиброз
ОИП - обычная интерстициальная пневмония
НСИП - неспецифическая интерстициальная пневмония
КЛФЭ - комбинация легочного фиброза и эмфиземы
ППФЭ - плевропаренхимальный фиброэластоз
СЗСТ - системное заболевание соединительной ткани
ИЗЛ-ЗСТ - интерстициальное заболевание легких, связанное с системным заболеванием соединительной ткани
ГЭР - гастроэзофагеальный рефлюкс
КТ - компьютерная томография органов грудной клетки
ВРКТ - высокоразрешающая компьютерная томография органов грудной клетки
ДИ - доверительный интервал
ХБЛ - хирургическая биопсия легкого
БАЛ - бронхоальвеолярный лаваж
ДАП - диффузное альвеолярное повреждение
АНА - антинуклеарные антитела
СРБ - С-реактивный белок
РФ - ревматоидный фактор
АЦЦП - антитела к циклическому цитруллинированному пептиду
ММП - матричная металлопротеиназа
КФК - креатинфосфокиназа
ФЖЕЛ - форсированная жизненная емкость легких
ЖЕЛ - жизненная емкость легких
ОЕЛ - общая емкость легких
ООЛ - остаточный объем легких
DLCO - диффузионная способность легких для монооксида углерода
ДЛА - давление в легочной артерии
срДЛА - среднее давление в легочной артерии
МКЗР - минимальная клинически значимая разница
6-МТ - тест с 6-минутной ходьбой
6-МР - 6-минутное расстояние
ГКС - глюкокортикостероиды
ЛГ - легочная гипертензия
ТЭЛА - тромбоэмболия легочной артерии
ОАС - обструктивное апноэ сна
ХОБЛ - хроническая обструктивная болезнь легких
ИБС - ишемическая болезнь сердца
ДКТ - длительная кислородотерапия
ХБЛ - хирургическая биопсия легкого
ИВЛ - инвазивная вентиляция легких
НВЛ - неинвазивная вентиляция легких
ОДН - острая дыхательная недостаточность
МПО - многопрофильное обсуждение
УУР - уровень убедительности рекомендаций
УДД - уровень достоверности доказательств -
ОШ - отношение шансов
ДИ - доверительный интервал
Термины и определения
Интерстициальные заболевания легких - гетерогенная группа заболеваний и патологических состояний известной и неизвестной природы, характеризующаяся распространенным, как правило, двусторонним поражением респираторных отделов легких (альвеол, респираторных бронхиол).
Идиопатические интерстициальные пневмонии - группа интерстициальных заболеваний легких неизвестной этиологии, сходными признаками которых являются: преимущественное поражение интерстициальной ткани, прогрессирующий фиброзирующий процесс в легких, сопровождающийся нарастающей с течением времени одышкой и рестриктивными нарушениями вентиляционной способности легких.
Идиопатический легочный фиброз - особая форма хронической прогрессирующей фиброзирующей интерстициальной пневмонии неизвестной этиологии; возникает преимущественно у людей старшего возраста, поражает только легкие и связана с гистологическим и/или компьютерно-томографическим паттерном обычной интерстициальной пневмонии.
Неспецифическая интерстициальная пневмония - одна из форм идиопатических интерстициальных пневмоний, характеризующаяся разнообразными гистологическими и компьютерно-томографическими признаками, нередко сходными с идиопатическим легочным фиброзом, но часто с положительным эффектом от глюкокортикостероидов и более благоприятным прогнозом.
Сотовое легкое - кластеры воздушных кист размером от 2 - 3 до 10 мм в легочной ткани, расположенные группами, субплеврально, в несколько слоев и имеющих четко очерченные стенки.
Тракционные бронхоэктазы - неравномерное расширение просветов бронхов и бронхиол, вызванное фиброзом легочной ткани и растяжением (тракцией) просвета бронхов легочной ткани в результате прогрессирующего фиброза.
Ретикулярные изменения - скиалогический феномен при ВРКТ органов грудной клетки, представляет собой сеть из относительно тонких перекрещивающихся линий (уплотнение внутридолькового интерстиция), которые могут иметь форму колец, многоугольников или параллельных линий.
"Матовое стекло" - скиалогический феномен при ВРКТ органов грудной клетки, который характеризуется умеренно выраженным повышением плотности легочной ткани, на фоне которого видны просветы и стенки бронхов, внутрилегочные сосуды, а также очаги и ретикулярные изменения, при их наличии.
Обострение ИЛФ - нарастание одышки в течение последних 30 дней и появление новых билатеральных изменений по данным высокоразрешающей компьютерной томографии органов грудной клетки по типу "матового стекла" и/или консолидатов при исключении других альтернативных причин (инфекция и др.).
Комбинация легочного фиброза и эмфиземы - синдром, объединяющий признаки двух заболеваний: легочного фиброза (преимущественно в нижних отделах легких) и эмфиземы (преимущественно в верхних отделах легких).
1. Краткая информация по заболеванию или состоянию (группы заболеваний или состояний)
1.1 Определение заболевания или состояния (группы заболеваний или состояний)
Идиопатический легочный фиброз (ИЛФ) - особая форма хронической прогрессирующей фиброзирующей интерстициальной пневмонии неизвестной этиологии, которая возникает преимущественно у людей старшего возраста, поражает только легкие и связана с гистологическим и/или компьютерно-томографическим (КТ) паттерном обычной интерстициальной пневмонии (ОИП) [1, 2, 3]. Гистологический паттерн ОИП включает наличие фибробластических фокусов, интерстициального хронического воспаления, фиброза преимущественно в зонах бронхиоло-альвеолярных переходов, в подплевральных/парасептальных зонах с формированием "сот". Паттерн ОИП при высокоразрешающей КТ (ВРКТ) органов грудной клетки включает распространенные двухсторонние ретикулярные изменения, признаки "сотового легкого" и/или тракционных бронхоэктазов с преобладанием изменений в кортикальных и базальных отделах легких.
1.2 Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
Этиология ИЛФ неизвестна, однако определены некоторые факторы риска, связанные с ИЛФ [4, 5]:
- курение. Это один из наиболее частых факторов риска, для которых доказана достоверная связь с ИЛФ. Значимость данного фактора риска возрастает у пациентов с анамнезом курения более 20 пачек-лет [6];
- внешнесредовые ингаляционные воздействия, не связанные с курением. Повышенный риск развития ИЛФ ассоциируется с широким спектром неорганических и органических пылей, в частности, с металлической (ОШ 2,44; 95% ДИ 1,74 - 3,40), древесной (ОШ 1,94; 95% ДИ 1,34 - 2,81) и каменной пылью (ОШ 1,97; 95% ДИ 1,09 - 3,55). В качестве потенциального фактора риска рассматривается ингаляционное воздействие органической пыли (растительная или животная) в сельском хозяйстве или в быту (ОШ 1,65; 95% ДИ 1,20 - 2,26) [7];
- гастроэзофагеальный рефлюкс (ГЭР). Взаимосвязь между ГЭР и ИЛФ окончательно не доказана [8];
- метаболические (эндокринные) расстройства. Метаболические (эндокринные) расстройства (сахарный диабет, гипотиреоз) встречаются значительно чаще среди больных ИЛФ и рассматриваются как независимый фактор риска для этого заболевания [9, 10];
- генетические факторы. Около 5% всей популяции больных ИЛФ имеют семейный легочный фиброз (среди кровных родственников). Наиболее часто (у 34% больных с семейным легочным фиброзом и у 38% пациентов с ИЛФ) встречается мутация MUC5B [11]; реже (в 25% случаев ИЛФ и в 15% случаев семейного легочного фиброза) мутации генов, связанных с теломеразой (TERT, TERC, DKC1, TINF2, RTEL1, PARN) и вызывающие укорочение теломерных участков; в 3%, в основном при семейном легочном фиброзе, - мутации в генах сурфактантных протеинов C (SP-C) и A2 (SP-A2) [12 - 16].
В основе патогенеза ИЛФ лежат повторные микроповреждения альвеолярного эпителия с нарушением механизмов его регенерации. Это приводит к патологической реэпителизации, пролиферации фибробластов и синтезу избыточного количества экстрацеллюлярного матрикса. В результате нормальная легочная паренхима постепенно замещается фиброзной тканью [6].
1.3 Эпидемиология заболевания или состояния (группы заболеваний или состояний)
Считается, что в последние годы число больных ИЛФ увеличилось. Однако показатели заболеваемости и распространенности ИЛФ в исследованиях разных авторов существенно отличаются, что можно объяснить отсутствием четких и общепринятых диагностических критериев, как рентгенологических, так и морфологических, отличиями в дизайнах исследований (разные определения ИЛФ, разный возрастной состав пациентов) и др. Заболеваемость ИЛФ зависит от возраста: болезнь возникает чаще в шестом и седьмом десятилетиях жизни. Большинство заболевших являются курильщиками или экс-курильщиками; мужчины болеют несколько чаще, чем женщины [17, 18]. По данным разных авторов, заболеваемость ИЛФ составляет от 6,8 до 63 случаев на 100 000 населения в зависимости от используемого определения ИЛФ [19 - 21].
Согласно предварительным данным, полученным по результатам регистра ИЛФ в Российской Федерации, распространенность ИЛФ в Российской Федерации составляет около 8 - 12 случаев на 100 000 населения, а заболеваемость ИЛФ - 4 - 7 случаев на 100 000 населения [22].
1.4 Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статической классификации болезней и проблем, связанных со здоровьем
Другие интерстициальные легочные болезни (J84):
Другие интерстициальные легочные болезни с упоминанием о фиброзе (J84.1)
1.5 Классификация заболевания или состояния (группы заболеваний или состояний)
Клиническая классификация ИЛФ отсутствует. По сочетанию специфических компьютерно-томографических и морфологических паттернов можно выделить:
- подтвержденный ИЛФ (наличие паттерна типичной ОИП у больного старше 60 лет при отсутствии клинически значимых внешнесредовых и лекарственных воздействий и отсутствии системных заболеваний соединительной ткани; соответствующее сочетание ВРКТ- и морфологического паттернов (Прил. Д)) [23];
- вероятный ИЛФ (соответствующее сочетание ВРКТ- и морфологического паттернов (см. Прил. Д)) [23];
- комбинация легочного фиброза с эмфиземой.
Пример формулировки диагноза:
а. Интерстициальное заболевание легких: идиопатический легочный фиброз. Хроническая гипоксемическая дыхательная недостаточность.
б. Интерстициальное заболевание легких: идиопатический легочный фиброз (комбинация легочного фиброза с эмфиземой). Буллезная эмфизема верхних отделов обоих легких. Хроническая гипоксемическая дыхательная недостаточность.
1.6 Клиническая картина заболевания или состояния (группы заболеваний или состояний)
Начало заболевания приходится, как правило, на возраст старше 50 лет [18], у больных с семейным анамнезом ИЛФ заболевание может начинаться в более молодом возрасте [24].
Основными клиническими проявлениями ИЛФ являются одышка, снижение толерантности к нагрузке и хронический кашель и такие неспецифические симптомы как слабость, снижение аппетита, потеря веса. Гипертермия, периферическая лимфаденопатия, артриты, миалгии, "свистящее" дыхание, кровохарканье, болевой синдром в грудной клетке и поражение левых камер сердца не характерны для ИЛФ [23, 25].
В отсутствие обострений естественное течение болезни характеризуется постепенным нарастанием симптомов в течение нескольких лет до развития тяжелых нарушений функции дыхания и присоединения осложнений [26].
Наиболее частой причиной смерти при ИЛФ (60%) является прогрессирующая дыхательная недостаточность, а также ишемическая болезнь сердца (ИБС), тромбоэмболия легочной артерии (ТЭЛА) и рак легкого [27]. Медиана выживаемости от момента постановки диагноза ИЛФ составляет от 2 до 3 лет [1], а от момента появления первых симптомов ИЛФ и/или изменений по КТ - 6 лет [28]. Вместе с тем, у больных с сохранной легочной функцией этот показатель может быть выше.
У 5 - 15% пациентов с ИЛФ в течение года развивается острое ухудшение клинического состояния - обострения ИЛФ [6]. Основными признаками обострения ИЛФ являются беспричинное нарастание одышки в течение 1 мес, усиление кашля и продукции мокроты, документированная гипоксемия (ухудшение или тяжелое нарушение газообмена), свежие альвеолярные инфильтраты на рентгенограмме легких и отсутствие других причин ухудшения, таких как экстра-паренхиматозные причины (пневмоторакс, плевральный выпот, ТЭЛА) или сердечная недостаточность с объемной перегрузкой сердца [26, 29 - 31]. Прогноз обострения ИЛФ, как правило, неблагоприятный, летальность во время госпитализации достигает 65%, а в течение 6 месяцев от начала развития обострения - > 90% [26].
2. Диагностика заболевания или состояния (группы заболеваний или состояний) медицинские показания и противопоказания к применению методов диагностики
Клиническое подозрение на ИЛФ у больного с хронической одышкой при физической нагрузке, кашлем, двухсторонней инспираторной крепитацией в базальных отделах легких и/или утолщением дистальных фаланг пальцев рук по типу "барабанных палочек", не имеющих очевидной причины, должно возникать в следующей ситуации: возраст старше 60 лет; отсутствие клинически значимых внешнесредовых или лекарственных воздействий; отсутствие признаков системных заболеваний соединительной ткани (СЗСТ) [17].
Критерии установления диагноза/состояния:
1) жалобы на одышку при отсутствии очевидных причин, клинически значимых внешнесредовых или лекарственных воздействий; отсутствие признаков СЗСТ;
2) двухсторонней инспираторной крепитацией в базальных отделах легких при аускультации;
4) выявление паттерна обычной интерстициальной пневмонии (ОИП) при ВРКТ органов грудной клетки и/или при патолого-анатомическом исследовании биоптатов легочной ткани.
2.1 Жалобы и анамнез
- При выявлении ИЗЛ рекомендуется тщательный сбор анамнеза приема лекарственных препаратов и воздействия факторов окружающей среды дома, на рабочем месте и в других местах, часто посещаемых пациентом, для исключения потенциальных причин ИЗЛ [23].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: Клиническое подозрение на ИЛФ у больного с хронической одышкой при физической нагрузке, кашлем, двухсторонней инспираторной крепитацией в базальных отделах легких и/или утолщением дистальных фаланг пальцев рук по типу "барабанных палочек", не имеющих очевидной причины, должно возникать в следующей ситуации: возраст старше 60 лет; отсутствие клинически значимых внешнесредовых или лекарственных воздействий; отсутствие признаков системных заболеваний соединительной ткани (СЗСТ) [17].
- Для оценки одышки при повседневных физических нагрузках у пациентов с ИЛФ рекомендуется использовать шкалу mMRC (Прил. Г) [32].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4)
- Для оценки тяжести и прогноза ИЛФ рекомендуется использовать шкалу GAP (Прил. Г2) [33].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4)
2.2 Физикальное обследование
У 40% пациентов с ИЛФ при первичном осмотре выявляются изменения дистальных фаланг по типу "барабанных палочек" и ногтевых пластин пальцев рук по типу "часовых стекол" различной выраженности. Выявляемая при аускультации двусторонняя крепитация в конце вдоха (хруст "липучки", или хрипы "velcro") в базальных отделах также характерна для пациентов с ИЛФ и тесно коррелирует с наличием паттерна обычной интерстициальной пневмонии (ОИП) при ВРКТ органов грудной клетки [34].
- У всех пациентов с ИЛФ рекомендуется оценивать состояние дистальных фаланг и ногтевых пластин пальцев рук для исключения изменения по типу "барабанных палочек" и "часовых стекол".
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: Выявление изменения дистальных фаланг по типу "барабанных палочек" и ногтевых пластин пальцев рук по типу "часовых стекол" при первичном осмотре больного с ИЛФ свидетельствует о развернутой стадии болезни и ассоциируется с плохим прогнозом [1].
- Всем пациентам с клиническим подозрением на ИЛФ рекомендуется проводить аускультацию легких для выявления двусторонней крепитации [34].
Уровень убедительности рекомендаций B (уровень достоверности доказательств 2)
2.3 Лабораторные диагностические исследования
- Для исключения ИЗЛ, связанных с СЗСТ (ИЗЛ-СЗСТ), всем больным с клиническим подозрением на ИЛФ рекомендуется выполнять исследование скорости оседания эритроцитов (СОЭ), исследование уровня С-реактивного белка (СРБ) в крови, определение содержания антинуклеарных антител (АНА) в крови (методом иммунофлюоресценции), определение содержания ревматоидного фактора (РФ) в крови, определение содержания антинуклеарных антител к Sm-антигену и определение содержания антител к циклическому цитрулиновому пептиду (анти-CCP) в крови [23].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: У больных с подозрением на ИЛФ и симптомами СЗСТ требуется более детальное исследование сывороточных маркеров СЗСТ:
- при подозрении на миозит: определение активности креатинкиназы в крови, исследование уровня миоглобина в крови, определение активности альдолазы в крови, определение содержания антицентромерных антител в крови и др.;
- при подозрении на системную склеродермию: определение содержания антител к Scl-70/топоизомеразе-1 в крови, определение содержания антицентромерных антител в крови;
- при подозрении на синдром Шегрена: определение содержания антител к SSA/Ro и SSB/La в крови;
- при подозрении на васкулит: определение маркеров ANCA-ассоциированных васкулитов: PR3 (c-ANCA), МПО (p-ANCA).
Выявление СЗСТ у больного с интерстициальными изменениями в легких исключает диагноз ИЛФ [1].
- Всем больным ИЛФ рекомендуется регулярно выполнять пульсоксиметрию (SpO2) в покое и при физической нагрузке (при выполнении теста с 6-минутной ходьбой (6-МТ)) для выявления десатурации [1].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: Выявление десатурации ниже 88% является показанием к назначению кислородотерапии.
2.4 Инструментальные диагностические исследования
2.4.1. Рентгенологическая диагностика
- Больным с подозрением на ИЛФ не рекомендуется проведение обзорной рентгенографии органов грудной клетки в связи с ее низкой информативностью [37]. Уровень убедительности рекомендаций C (уровень достоверности доказательств 3)
- Всем больным с клиническим подозрением на ИЛФ рекомендуется проведение ВРКТ органов грудной клетки для подтверждения диагноза ИЛФ [23].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- КТ органов грудной клетки с внутривенным контрастированием рекомендуется больным с ИЗЛ только для исключения тромбоэмболии легочной артерии [23].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: Технические требования к ВРКТ органов грудной клетки у больных ИЛФ:
- тонкие томографические срезы (<= 1 мм) [38];
- алгоритм высокого пространственного разрешения [39];
- изображения должны быть получены на максимально глубоком вдохе;
- спиральное (объемное) сканирование;
- при сомнительных результатах сканирования в положении на спине рекомендовано выполнение сканирования в положении на животе для устранения "гравитационного эффекта" [40] и экспираторной КТ для выявления "воздушных ловушек" [41];
Изменения на ВРКТ органов грудной клетки отражают морфологические изменения в легких, которые при ИЛФ представляют собой паттерн ОИП.
Основными признаками ОИП при ВРКТ органов грудной клетки являются:
- преобладание изменений в кортикальных и базальных отделах легких;
- диффузные двухсторонние ретикулярные изменения;
- мелкие субплевральные воздушные кисты ("сотовое легкое") и/или
- периферические тракционные бронхо- или бронхиолоэктазы [42] (Рис. 1 - 3).
"Матовое стекло" может присутствовать на фоне ретикулярных изменений и "сотового легкого", но не должно превалировать над другими изменениями. Такое "матовое стекло" является признаком фиброза [43].
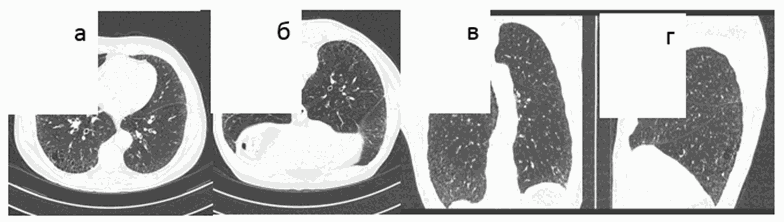
Рис. 1. Обычная интерстициальная пневмония, типичная
ВРКТ-картина. а) аксиальный срез, б) фронтальная реформация,
в) сагиттальная реформация, д) аксиальный срез в положении
на животе. Кортикальное распределение изменений
с нарастанием их от верхушек к диафрагме, "сотовое легкое",
ретикулярные изменения, отсутствие "матового стекла".
Исследование в положении на животе подтверждает
отсутствие "матового стекла".

Рис. 2. Обычная интерстициальная пневмония, типичная
картина. Сотовое легкое на аксиальном срезе (а),
при реформации во фронтальной (б)
и сагиттальной (в) плоскостях.

Рис. 3. Обычная интерстициальная пневмония, типичная
картина. Тракционные бронхоэктазы в кортикальных отделах
легких на реформации в косой плоскости (а)
и аксиальном срезе (б)
Выделяют несколько паттернов ОИП по данным ВРКТ органов грудной клетки (Табл. 1).
Таблица 1. Компьютерно-томографические диагностические категории ОИП
Типичная ОИП
Вероятная ОИП
Сомнительная ОИП
ВРКТ-картина, не соответствующая ОИП
Распределение
Преобладание в базальных отделах (реже диффузно) и субплеврально; распределение обычно гетерогенное
Преобладание в базальных и субплевральных отделах; распределение обычно гетерогенное
Вариабельное или диффузное
Преобладание в верхних и средних отделах; перибронховаскулярные изменения с интактностью субплевральных отделов
Признаки
"Сотовое легкое"; ретикулярные изменения с периферическими тракционными бронхо- и бронхиолоэктазами <*>; отсутствие признаков, позволяющих заподозрить альтернативный диагноз
Ретикулярные изменения с периферическими тракционными бронхо- и бронхиолоэктазами; отсутствует "сотовое легкое"; отсутствие признаков, позволяющих заподозрить альтернативный диагноз
Фиброз без каких-либо особенностей, позволяющих заподозрить ОИП
Любые из перечисленных: преобладание консолидации, распространенное "матовое стекло" (без признаков обострения ИЛФ), распространенная мозаичность с четко очерченными "воздушными ловушками" на выдохе, множественные очаги или кисты
--------------------------------
Примечание: <*> Могут присутствовать слабо выраженное "матовое стекло", ретикулярные изменения, оссификация.
- При ВРКТ-паттерне типичной ОИП и клинических данных, соответствующих ИЛФ, не рекомендуется выполнение биопсии легкого (хирургической, трансбронхиальной или криобиопсии) и бронхоальвеолярного лаважа (БАЛ) для подтверждения диагноза [23].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: В соответствующей клинической ситуации специфичность паттерна типичной ОИП для диагностики ИЛФ при ВРКТ органов грудной клетки достигает 94 - 100%, что позволяет поставить диагноз ИЛФ без инвазивных диагностических вмешательств [44, 45].
- Больным с клиническим подозрением на ИЛФ и выявлением паттернов вероятной ОИП, сомнительной ОИП или альтернативного диагноза при ВРКТ органов грудной клетки рекомендуется выполнение хирургической биопсии легкого для подтверждения диагноза [23].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: ВРКТ-паттерны вероятной или сомнительной ОИП менее специфичны для ИЛФ и поэтому требуют хирургической биопсии легкого с целью более точной оценки прогноза и выбора более специфичной терапии [23, 46].
В настоящее время опубликовано недостаточно доказательных данных для разработки рекомендаций за или против использования других видов биопсии легкого (трансбронхиальной биопсии (ТББЛ) или криобиопсии) у больных с клиническим подозрением на ИЛФ и паттерном вероятной ОИП, сомнительной ОИП или альтернативного диагноза на ВРКТ органов грудной клетки [23].
- Больным с клиническим подозрением на ИЛФ и выявлением паттернов вероятной ОИП, сомнительной ОИП или альтернативного диагноза на ВРКТ органов грудной клетки рекомендуется цитологический анализ бронхоальвеолярного лаважа для дифференциальной диагностики с другими ИЗЛ [23].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: Клеточный состав БАЛ может помочь в дифференциальной диагностике ИЛФ с другими фиброзирующими ИЗЛ. Так, при ИЛФ процентное содержание нейтрофилов в БАЛ выше, чем при гиперчувствительном пневмоните, НСИП и эозинофильной пневмонии; процентное содержание эозинофилов ниже, чем при эозинофильной пневмонии, процентное содержание лимфоцитов ниже, чем при НСИП, саркоидозе, криптогенной организующейся пневмонии (КОП) и лимфоцитарной интерстициальной пневмонии (ЛИП; соотношение CD4/CD в БАЛ при ИЛФ ниже, чем при саркоидозе, и выше, чем при НСИП [23].
- При одновременном выявлении на ВРКТ органов грудной клетки паттерна ОИП и эмфиземы рекомендуется указывать в диагнозе комбинацию легочного фиброза с эмфиземой (КЛФЭ) в связи с особым течением такого фенотипа ИЛФ [23].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: Клинической особенностью синдрома КЛФЭ является наличие выраженной одышки при нередко нормальных спирографических показателях [1], а также большая распространенность и тяжесть ЛГ, существенно ухудшающая прогноз заболевания [47].
- Больных с клиническим подозрением на ИЛФ, паттерном ОИП и признаками плевропаренхиматозного фиброэластоза (ППФЭ) на ВРКТ органов грудной клетки после многопрофильного обсуждения рекомендуется расценивать как больных с ИЛФ в связи со сходным клиническим течением и прогнозом этих заболеваний [23].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: ППФЭ - прогрессирующее фиброзирующее ИЗЛ неизвестной этиологии. Для ППФЭ типичны неравномерное утолщение плевры и наличие участков субплевральной консолидации легочной паренхимы в верхних и средних отделах легких на ВРКТ органов грудной клетки.
2.4.2. Морфологическая диагностика
Основой морфологической диагностики ИЛФ является выявление морфологического паттерна ОИП.
- Морфологический диагноз ОИП рекомендуется выставлять больным с ИЗЛ при выявлении в биоптатах легочной ткани гетерогенных изменений архитектоники легких за счет участков плотного фиброза, часто с формированием "сотовых" структур, в сочетании с участками менее пораженной (или сохранной) паренхимы и при отсутствии признаков альтернативного заболевания легких [1].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: Эти патогистологические изменения обычно наиболее выражены в субплевральных и парасептальных зонах (Рис. 4). Интерстициальное воспаление обычно выражено умеренно, в виде очаговых инфильтратов, состоящих из лимфоцитов и плазматических клеток. В зонах фиброза могут встречаться так называемые фибробластические фокусы, состоящие из пролиферирующих фибробластов и миофибробластов (Рис. 5). "Сотовые" структуры представляют собой кистозные полости с фиброзной стенкой, обычно выстланные бронхиолярным эпителием, которые могут содержать слизь и клетки воспаления (Рис. 6).
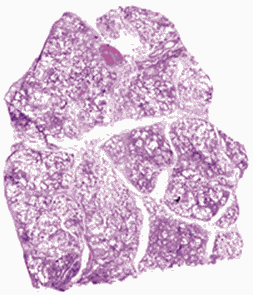
Рис. 4. Обычная интерстициальная пневмония: участки фиброза
в подплевральных и парасептальных зонах
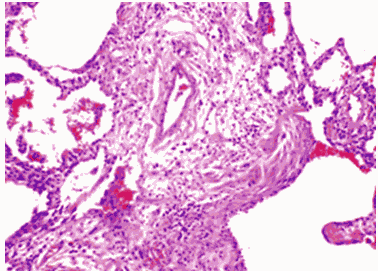
Рис. 5. Обычная интерстициальная пневмония:
миофибробластический фокус в месте перехода респираторной
бронхиолы в альвеолы
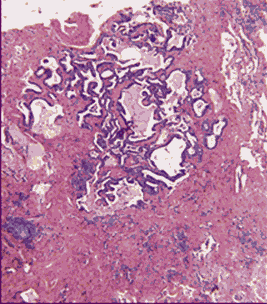
Рис. 6. Обычная интерстициальная пневмония:
"сотовые" структуры
Выделены несколько гистологических паттернов ОИП (Табл. 2) [23].
Таблица 2. Гистологические паттерны и признаки ОИП
Типичная ОИП
Вероятная ОИП
Сомнительная ОИП
Альтернативный диагноз
Плотный фиброз с нарушениями архитектоники легочной ткани ("сотовое легкое")
Присутствуют некоторые признаки типичной ОИП, но их выраженность не позволяет говорить о типичной ОИП/ИЛФИ
Фиброз с нарушениями архитектоники или без них, с признаками паттерна ОИП или вторичной ОИП, вызванной другим фибротическим заболеванием легких <*>
Признаки других ИИП (например, отсутствие фибробластических фокусов или рыхлый фиброз) во всех биоптатах
Преимущественно субплевральное и парасептальное распределение фиброза
отсутствие признаков альтернативного заболевания
Гистологические признаки других заболеваний (гиперчувствительный пневмонит, лангергансоклеточный гистиоцитоз, саркоидоз, лимфангиолейомиоматоз)
Очаговый фиброз
ИЛИ
Некоторые признаки типичной ОИП, но при этом имеются признаки альтернативного заболевания <#>
Фибробластические фокусы
наличие только "сотового легкого"
Отсутствие признаков альтернативного заболевания
Примечания: <*> Гранулемы, гиалиновые мембраны (отличающиеся от таковых при обострении ИЛФ), выраженное перибронхиальное распределение изменений, участки интерстициального воспаления, не связанные с фиброзом, выраженный хронический фиброз плевры, организующаяся пневмония.
<#> - Воспалительные клеточные инфильтраты вне зон "сотового легкого", выраженная лимфоидная гиперплазия, в том числе с вторичными герминативными центрами, четкое перибронхиальное распределение изменений, в том числе с распространенной перибронхиолярной метаплазией.
2.4.3. Функциональная диагностика
Легочные функциональные тесты у больных с ИЛФ обычно выявляют рестриктивные вентиляционные нарушения с уменьшением легочных объемов и снижением DLCO [48].
- Всем пациентам с ИЛФ рекомендуется выполнять исследование неспровоцированных дыхательных объемов и потоков для уточнения характера и выраженности нарушений легочной вентиляции, а также мониторирования скорости прогрессирования ИЛФ [1].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: Значение форсированной жизненной емкости легких (ФЖЕЛ) для прогноза летальности в период постановки диагноза ИЛФ окончательно не установлено, однако снижение ФЖЕЛ в абсолютных значениях на > 10% в течение 12 мес. в процессе наблюдения за больным свидетельствует о прогрессировании заболевания и является суррогатным маркером риска летальности [1].
- Всем пациентам с ИЛФ рекомендуется измерение диффузионной способности легких по монооксиду углерода (DLco) для выявления нарушений газообменной функции легких [1].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: Величина DLCO < 40% от должного значения в период постановки ИЛФ является достоверным фактором риска смерти [35]. Снижение DLco в абсолютных значениях на > 15% (наряду со снижением ФЖЕЛ или без такового) в течение 12 мес в процессе наблюдения за больным при отсутствии альтернативных причин свидетельствует о прогрессировании заболевания и является суррогатным маркером риска летальности [1]. На ранних стадиях ИЛФ может быть выявлено изолированное снижение DLCO при нормальных легочных объемах. Прогрессирующее изолированное снижение DLco при мониторировании течения заболевания требует исключения патологии легочных сосудов, в первую очередь, легочной гипертензии [49].
- Всем пациентам с ИЛФ рекомендуется выполнять тест с 6-минутной ходьбой (6-МТ) для объективной оценки их функционального состояния, потребности в кислородотерапии, определении прогноза, а также оценки эффективности легочной реабилитации [1].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: Прогностическое значение имеют несколько параметров 6-МТ: пройденное расстояние, десатурация < 88% и скорость восстановления пульса по окончании теста [50 - 52]. 6-МТ позволяет прогнозировать летальность больных ИЛФ, ожидающих трансплантацию легких [53, 54]. 6-МТ не показан больным, у которых ходьба лимитирована другими причинами (например, патологией опорно-двигательного аппарата), и больным с поздними стадиями ИЛФ [55].
2.5 Иные диагностические исследования
- Многопрофильное обсуждение (МПО) рекомендуется проводить для всех пациентов с подозрением на ИЛФ с целью подтверждения диагноза ИЛФ и обсуждения тактики лечения [17, 24].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: МПО необходимо всем больным с фибротическими ИЗЛ для установления диагноза, определения потребности в биопсии легкого и других диагностических мероприятиях, а также выбора оптимальной терапии. В состав многопрофильной группы специалистов должны обязательно входить врач-пульмонолог, врач-рентгенолог и врач-патологоанатом с опытом диагностики ИЗЛ, также возможно участие врача-ревматолога, врача-профпатолога, в отдельных случаях - врача-генетика. Обсуждение может проводиться с помощью телемедицинской коммуникации [24].
3. Лечение, включая медикаментозную и немедикаментозную терапии, диетотерапию, обезболивание, медицинские показания и противопоказания к применению методов лечения
3.1. Консервативное лечение
3.1.1. Медикаментозное лечение
В настоящее время монотерапия ГКС не рекомендуется для лечения ИЛФ [56 - 60].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: По данным ретроспективных исследований, монотерапия ГКС не влияет на выживаемость больных ИЛФ [56, 57]. Длительная терапия ГКС может сопровождаться серьезными побочными эффектами [58, 59, 60].
- В настоящее время терапия противоопухолевыми препаратами (цитостатиками), как в виде монотерапии, так и в комбинации с ГКС, не рекомендуется для лечения ИЛФ [2].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: В настоящее время нет убедительных доказательств об улучшении выживаемости больных ИЛФ, получавших противоопухолевые препараты (цитостатики) (аналоги азотистого иприта: циклофосфамид** (Код АТХ: L01AA01), другие иммунодепрессанты: азатиоприн** (Код АТХ: L04AX01)) как в виде монотерапии, так и при комбинации с ГКС [1]. Терапия противоопухолевыми препаратами (цитостатиками) может сопровождаться развитием серьезных побочных эффектов.
- Монотерапию ацетилцистеином** (Код АТХ: R05CB01) не рекомендуется назначать всем больным ИЛФ в рутинном порядке [2, 61].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: Монотерапия ацетилцистеином** достоверно не улучшала ни один из значимых для больного показателей, включая выживаемость [62, 63]. Терапия ацетилцистеином** может быть эффективной у пациентов ИЛФ с определенными генетическими полиморфизмами (например, TT генотипом TOLLIP), а также у больных интерстициальной пневмонией с аутоиммунными проявлениями (при наличии КТ- или гистологического паттерна ОИП и положительных АНА) [64].
- Комбинированная терапия ацетилцистеином**, азатиоприном** и преднизолоном** (Код АТХ: H02AB06) ("тройная комбинация") не рекомендуется для лечения ИЛФ [2].
Уровень убедительности рекомендаций C; уровень достоверности доказательств 5.
Комментарии: Комбинированная терапия пероральным ацетилцистеином**, азатиоприном** и преднизолоном** ("тройная комбинация") не оказывает значимого влияния на функциональные показатели, летальность и частоту обострений ИЛФ [65, 66].
- Амбризентан** (Код АТХ: C02KX02) не рекомендуется для лечения ИЛФ независимо от наличия или отсутствия у них ЛГ [2].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: Если пациент с ИЛФ и ЛГ принимает амбризентан**, лечение должно быть прекращено в связи с прогрессирующим снижением легочной функции на фоне терапии амбризентаном** у больных ИЛФ [67]
- Силденафил (Код АТХ: G04BE03), бозентан** (Код АТХ: C02KX01) и мацитентан** (Код АТХ: C02KX04) не рекомендуются для лечения ИЛФ [2].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: Силденафил, бозентан** и мацитентан** не рекомендуется применять для лечения ИЛФ в связи с отсутствием положительных клинических результатов и высокой частотой серьезных побочных эффектов [2]. Силденафил может использоваться у больных ИЛФ по другим показаниям, таким как легочная гипертензия или другие варианты дисфункции правого желудочка [2]. Бозентан** и мацитентан** не оказывают положительного влияния на легочную гемодинамику у больных ИЛФ даже при наличии ЛГ [2].
- Варфарин** (Код АТХ: B01AA03) не рекомендуется для лечения ИЛФ [2].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: Применение перорального варфарина** для лечения ИЛФ связано с повышением риска летального исхода [68] При наличии у больного ИЛФ показаний к антикоагулянтной терапии, например, тромбоза глубоких вен голени, мерцательной аритмии, варфарин может использоваться в качестве антикоагулянта в соответствии с существующими клиническими рекомендациями для лечения этих заболеваний. Данная рекомендация не распространяется на применение других антикоагулянтов, назначаемых по другим показаниям [2].
- Ингибиторы протонного насоса рекомендуются в лечении больных ИЛФ при наличии клинически значимого ГЭР [69, 70].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: В ряде исследований установлено, что добавление к терапии ИЛФ ингибиторов протонного насоса повышает ФЖЕЛ, снижает частоту обострений [69] и улучшает выживаемость больных ИЛФ [70]. Больные, получающие пирфенидон** (Код АТХ: L04AX05), не должны лечиться омепразолом** (Код АТХ: A02BC01) ввиду нежелательного лекарственного взаимодействия, в то время как другие ингибиторы протонного насоса могут использоваться одновременно с пирфенидоном** [70].
- Всем больным ИЛФ рекомендуется лечение противоопухолевыми препаратами и другими иммунодепрессантами (антифибротическими препаратами) - нинтеданибом** или пирфенидоном** [71].
Уровень убедительности рекомендаций B (уровень достоверности доказательств 1)
Комментарии: В настоящее время клиническая эффективность в лечении ИЛФ доказана только для двух препаратов, зарегистрированных в Российской Федерации: нинтеданиба** (Код АТХ: L01XE31) и пирфенидона** (Код АТХ: L04AX05).
Терапия нинтеданибом** или пирфенидоном** позволяет затормозить скорость снижения ФЖЕЛ, уменьшить риск обострений ИЛФ и риск летального исхода [72, 73]. Показана сходная эффективность нинтеданиба** и пирфенидона** у больных с разной тяжестью функциональных нарушений [77, 84]. Поскольку целью лечения является замедление прогрессирования заболевания, длительность лечения не определена [69].
В клинических исследованиях 2 - 3 фазы, препарат нинтеданиб** показал снижение частоты обострений на 47% [77], средняя выживаемость у пациентов, получавших нинтеданиб** на основе распределения Вейбула, составила 11,6 (95% ДИ 9,6 - 14,1) лет [72]. В исследованиях третьей фазы нинтеданиб** был исследован у пациентов с ВРКТ-паттерном вероятной ОИП без хирургической биопсии легкого, с ФЖЕЛ > 90% должн., с нормальными значениями соотношения ОФВ1/ФЖЕЛ, а также у пациентов старше 80 лет [83].
Рекомендации по использованию разных групп лекарственных средств в терапии ИЛФ суммированы в таблице 4.
Таблица 4. Рекомендации по фармакологической терапии ИЛФ
Не назначать
Терапия не рекомендована
Терапия возможна
Терапия рекомендована
Азатиоприн** + преднизолон** + Ацетилцистеин** ("тройная комбинация")
Варфарин**
Амбризентан**
ГКС
Цитостатики
Бозентан**
Мацитентан**
Силденафил
ацетилцистеин**
Антирефлюксная терапия
Нинтеданиб**
Пирфенидон**
- Ведение больных ИЛФ с хроническим кашлем рекомендуется осуществлять по принципам, принятым для ведения других больных с хроническим кашлем [85].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- У больных ИЛФ с хроническим кашлем ингибиторы протонного насоса рекомендуется назначать только при наличии ГЭР [85].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Больным с хроническим кашлем, рефрактерным к стандартной терапии и нарушающим повседневную активность больного, при неэффективности других методов лечения рекомендуется назначение опиоидных анальгетиков в рамках паллиативной помощи [84].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: При назначении опиоидных анальгетиков требуется тщательная оценка эффективности и побочных эффектов через 1 неделю лечения и затем ежемесячно в период их использования [85].
Методы терапии обострения ИЛФ с доказанной эффективностью, включая глюкокортикостероидные лекарственные средства, отсутствуют. В связи с этим настоящее время невозможно предоставить специфические рекомендации о дозах, пути введения и длительности терапии ГКС либо другими лекарственными препаратами при обострении ИЛФ [69].
3.1.2. Немедикаментозное лечение
Длительная кислородотерапия (ДКТ)
- Пациентам с ИЛФ и клинически значимой гипоксемией в покое (при SpO2 менее 88% в покое при дыхании комнатным воздухом) рекомендуется проведение ДКТ [1].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: Косвенные доказательства о пользе ДКТ при ИЛФ основаны на данных, полученных для больных хронической обструктивной болезнью легких (ХОБЛ). Аналогично больным с ХОБЛ, при назначении ДКТ больным ИЛФ ее длительность должна составлять не менее 15 - 17 часов в сутки, включая период ночного сна [86, 87].
Неинвазивная вентиляция легких
- Применение неинвазивной вентиляции легких (НВЛ) с положительным давлением на вдохе рекомендуется у пациентов с ИЛФ и гиперкапнией во время стационарной легочной реабилитации [69], а также у больных с острой дыхательной недостаточностью (ОДН) на фоне обострения ИЛФ [88].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: НВЛ с положительным давлением на вдохе во время ночного сна у больных с ИЗЛ, включая ИЛФ, и гиперкапнией улучшала переносимость физической нагрузки и качество жизни [89].
Положительный эффект в виде снижения летальности от ОДН и риска интубации был достигнут у небольшого числа (44 - 45%) больных, хотя отсутствие НВЛ не влияло на прогноз умерших больных [88].
Искусственная вентиляция легких (ИВЛ)
- Большинству больных ИЛФ не рекомендуется проведение ИВЛ за исключением случаев, когда планируется проведение трансплантации легких [1].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: Опубликовано несколько небольших исследований ИВЛ у больных с ИЛФ и дыхательной недостаточностью, во всех получена высокая внутрибольничная летальность [90 - 92], хотя исследования несли риск систематических ошибок.
3.2. Хирургическое лечение
Трансплантация легких
- Пациентам с ИЛФ при наличии соответствующих показаний (Табл. 5) рекомендуется проведение трансплантации легких [93].
Уровень убедительности рекомендаций C; уровень достоверности доказательств 4.
Комментарии: В отдельных исследованиях показано снижение риска летального исхода в течение 5 лет после трансплантации у больных ИЛФ [93], однако точные данные о наиболее оптимальном времени трансплантации при этом заболевании отсутствуют [69]. В систематическом обзоре 54 исследований показана более хорошая выживаемость после трансплантации обоих легких по сравнению с трансплантацией одного легкого, однако эти результаты могут быть связаны с особенностями отбора больных для одно- либо двусторонней трансплантации легких [93].
Таблица 5. Показания к трансплантации легких при ИЛФ [69].
Морфологический или КТ-паттерн ОИП плюс один из признаков:
- DLCO ниже 40% от должных величин
- Снижение ФЖЕЛ на 10% и более в течение 6 мес наблюдения
- Снижение SpO2 ниже 88% во время 6-MT.
- "Сотовое легкое" на ВРКТ (> 2 баллов по шкале фиброза).
4. Медицинская реабилитация, медицинские показания и противопоказания к применению методов реабилитации
- Всем пациентам с ИЛФ рекомендуется проводить легочную реабилитацию, объем которой определяется тяжестью состояния больного [94].
Уровень убедительности рекомендаций B (уровень достоверности доказательств 2)
Комментарии: Легочная реабилитация больных с ИЛФ должна включать аэробные тренировки скелетной и дыхательной мускулатуры, образование больных, коррекцию нутритивного статуса и психологическую помощь. Эти меры могут уменьшить одышку, улучшить переносимость повседневных физических нагрузок и качество жизни независимо от тяжести функциональных нарушений [94].
5. Профилактика и диспансерное наблюдение, медицинские показания и противопоказания к применению методов профилактики
Наблюдение за больными ИЛФ необходимо для активного выявления случаев прогрессирующего течения заболевания, для оценки динамики симптомов и выявления осложнений терапии [1].
- Всем пациентам с ИЛФ рекомендуется измерять ФЖЕЛ и DLCO для мониторирования течения заболевания в повседневной врачебной практике с интервалом в 3 - 6 мес [1].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: В нескольких когортных клинических исследованиях подтверждено, что снижение абсолютных значений ФЖЕЛ на 10% (с одновременным снижением DLCO или без) либо снижение абсолютных значений DLCO на 15% (с одновременным снижением ФЖЕЛ или без) является суррогатным маркером летальности и, при отсутствии других объяснений, маркером прогрессирования заболевания [35, 95]. Прогрессирование болезни также может отражать меньшее (на 5 - 10%), но неуклонное снижение ФЖЕЛ [96].
- При каждом посещении больного ИЛФ рекомендуется оценивать оксигенацию в покое с помощью пульсоксиметра [1].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: Оксигенация с помощью пульсоксиметра должна оцениваться в покое и при физической нагрузке у всех больных вне зависимости от симптомов, для выявления потребности в кислородотерапии. Такие измерения следует выполнять исходно и через каждые 3 - 6 мес. наблюдения.
- При быстром ухудшении респираторных симптомов следует исключить обострение ИЛФ и другие возможные причины, например ТЭЛА, пневмоторакс, респираторную инфекцию, аспирацию [1].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: У больных ИЛФ могут развиваться такие сопутствующие состояния, как ЛГ, ТЭЛА, рак легкого, ИБС, которые влияют на выживаемость. Однако роль рутинного скрининга для диагностики этих состояний и заболеваний у больных ИЛФ (например, ежегодная ВРКТ для ранней диагностики рака легкого) не изучена.
6. Организация оказания медицинской помощи
Плановое ведение больного с ИЛФ осуществляется в условиях первичной специализированной (амбулаторной) медицинской помощи.
Показания для госпитализации в медицинскую организацию:
1) плановая госпитализация в стационар осуществляется для подтверждения диагноза ИЛФ (выполнение хирургической биопсии легкого);
2) экстренная госпитализация в стационар осуществляется при обострении ИЛФ (нарастание одышки, ухудшение оксигенации) либо при развитии осложнений ИЛФ (ТЭЛА, острая инфекция нижних дыхательных путей).
Показания к выписке пациента из медицинской организации:
1) стабилизация клинического состояния;
2) сатурация крови кислородом не ниже 93% в покое при дыхании комнатным воздухом или на фоне кислородотерапии.
7. Дополнительная информация (в том числе факторы, влияющие на исход заболевания или состояния)
В силу возраста - 60 лет и старше - у больных ИЛФ часто имеются многочисленные сопутствующие заболевания, осложняющие течение и лечение ИЛФ и негативно влияющие на прогноз.
Рак легкого
У 12 - 14% больных ИЛФ развивается периферический рак легкого, чаще аденокарцинома, плоскоклеточный и мелкоклеточный рак [97, 98]. Эти заболевания имеют общие факторы риска и патогенетические механизмы. Однако в силу невысокой частоты такого сочетания доказательная информация по лечению ИЛФ в сочетании с раком легкого отсутствует. В то же время сочетание ИЛФ с раком легкого значительно повышает риск летального исхода по сравнению с больными ИЛФ без рака легкого [99].
Легочная гипертензия
ЛГ - повышение срДЛА >= 25 мм рт. ст. по данным катетеризации правых камер сердца - наиболее частое осложнение ИЛФ (20 - 84%, по данным разных авторов). Формирование ЛГ ведет к усилению одышки, снижению физических резервов пациента, повышает риск летального исхода [1].
- Большинству больных ИЛФ с ЛГ не рекомендуется назначение специфических препаратов для лечения ЛГ, однако у отдельных больных такая терапия может улучшить легочную гемодинамику и переносимость физической нагрузки [1].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: В целом, наиболее обоснованным методом терапии ЛГ при заболеваниях легких остается длительная кислородотерапия в домашних условиях. У больных с тяжелой ЛГ (срДЛА > 35 мм рт. ст.), подтвержденной при катетеризации правых отделов сердца, возможна пробная терапия силденафилом, который может улучшить легочную гемодинамику и переносимость физической нагрузки без ухудшения оксигенации [100 - 102]. Также есть отдельные данные о положительных эффектах ингаляционного илопроста (Код АТХ: B01AC11) [103] и бозентана [104]. Необходимы специальные клинические исследования по терапии ЛГ у больных ИЛФ.
Гастроэзофагеальный рефлюкс
ГЭР сопровождается микроаспирацией желудочного содержимого и может рассматриваться как триггер альвеолярного повреждения и фактор, ухудшающий течение ИЛФ, однако нередко протекает бессимптомно.
- Большинству больных ИЛФ с бессимптомным ГЭР рекомендуется медикаментозное лечение ГЭР, хотя у отдельных больных оно нецелесообразно [1].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Больным ИЛФ с ГЭР рекомендованы модификация образа жизни (прием малых порций пищи, подъем головного конца кровати), а при клинически значимом ГЭР, не контролируемом медикаментозной терапией, и объективном подтверждении тяжелого кислого рефлюкса рекомендуется фундопликация [105].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: Опубликованы доказательства того, что медикаментозное или хирургическое лечение ГЭР позволяет стабилизировать функцию легких и замедлить прогрессирование ИЛФ [105 - 108]. Фундопликация желудка по Ниссену, которая уменьшает как кислотный рефлюкс, так и некислотный рефлюкс и микроаспирацию, улучшает выживаемость пациентов ИЛФ [109]. Модификация образа жизни (прием малых порций пищи, подъем головного конца кровати и др.) являются оправданными рекомендациями для пациентов ИЛФ с симптомами ГЭР [105].
Обструктивное апноэ сна (ОАС)
У 20 - 68% больных ИЛФ встречается ОАС, определяемое как увеличение индекса апноэ-гипопноэ > 15 эпизодов в час [110]. Сопряженная с ОАС гиповентиляция усугубляет гипоксемию и ЛГ [111].
- Всем больным ИЛФ рекомендуется проводить скрининг ночной десатурации с последующей диагностикой ОАС [111].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Больным ИЛФ с ночной десатурацией рекомендуется назначение кислородотерапии во время ночного сна в качестве паллиативного лечения [110].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: Диагностика ОАС у больных ИЛФ сложна, так как дневная сонливость и слабость характерны для обоих состояний. В то же время ночная десатурация встречается при ИЛФ достаточно часто. По результатам единичных исследований, CPAP-терапия у больных ИЛФ улучшает качество жизни, однако не влияет на летальность. [111].
Критерии оценки качества медицинской помощи
Код/коды по МКБ-10: J84.1
N п/п
Критерии качества
Оценка выполнения
1.
Выполнена компьютерная томография органов грудной клетки
Да/Нет
2.
Выполнено исследование серологических маркеров системных ревматических заболеваний (исследование уровня С-реактивного белка (СРБ) в крови, определение содержания антител к циклическому цитрулиновому пептиду (анти-CCP) в крови, определение содержания ревматоидного фактора (РФ) в крови, определение содержания антинуклеарных антител (АНА) в крови при первичной диагностике)
Да/Нет
3.
Проведена пульсоксиметрия
Да/Нет
4.
Проведено исследование неспровоцированных дыхательных объемов и потоков
Да/Нет
5.
Выполнен 6-минутный тест
Да/Нет
6.
Проведена длительная кислородотерапия (при SpO2 менее 88% в покое при дыхании комнатным воздухом)
Да/Нет
7.
Выполнена рекомендация назначения антифибротической терапии
Да/Нет
Список литературы
1. Raghu G., Collard H.R., Egan J.J. and ATS/ERS/JRS/ALAT Committee on Idiopathic Pulmonary Fibrosis. An official ATS/ERS/JRS/ALAT statement: idiopathic pulmonary fibrosis; evidence-based guidelines for diagnosis and management. Am J Respir Crit Care Med 2011; 183: 788 - 824.
2. Raghu G., Rochwerg B., Zhang Y. et al. An Official ATS/ERS/JRS/ALAT Clinical Practice Guideline: Treatment of Idiopathic Pulmonary Fibrosis: Executive Summary An Update of the 2011 Clinical Practice Guideline. Am J Respir Crit Care Med 2015; 192: e3 - e19.
3. Travis\ W.D., Costabel U., Hansell D.M. and ATS/ERS Committee on Idiopathic Interstitial Pneumonias. An official American Thoracic Society/European Respiratory Society statement: update of the international multidisciplinary classification of the idiopathic interstitial pneumonias. Am J Respir Crit Care Med 2013; 188: 733 - 748.
4. Hodgson U., Pulkkinen V., Dixon M. et al. ELMOD2 is a candidate gene for familial idiopathic pulmonary fibrosis. Am J Hum Genet 2006; 79: 149 - 154.
5. Allen R.J., Porte J., Braybrooke R. et al. Genetic variants associated with susceptibility to idiopathic pulmonary fibrosis in people of European ancestry: a genome-wide association study. Lancet Respir Med 2017; 5 (11): 869 - 880.
6. Авдеев С.Н. Идиопатический фиброз легких: новая парадигма. Тер Архив 2017; 89 (N 1): 112 - 122. DOI: 10.17116/terarkh2017891112-122
7. Taskar V.S., Coultas D.B. Is idiopathic pulmonary fibrosis an environmental disease. Proc Am Thorac Soc. 2006; 3: 293 - 298.
8. Bedard Methot D., Leblanc E., Lacasse Y. Meta-analysis of gastroesophageal reflux disease and idiopathic pulmonary fibrosis. Chest 2019; 155 (1): 33 - 43.
9.  Figueroa M.C., Carrillo G.,
Figueroa M.C., Carrillo G.,  R. et al. Risk factors for idiopathic pulmonary fibrosis in a Mexican population. A case-control study. Respir Med 2010; 104: 305 - 309.
R. et al. Risk factors for idiopathic pulmonary fibrosis in a Mexican population. A case-control study. Respir Med 2010; 104: 305 - 309.
10. Oldham J.M., Kumar D., Lee C. et al. Thyroid disease is prevalent and predicts survival in patients with idiopathic pulmonary fibrosis. Chest 2015; 148 (3): 692 - 700.
11. Stock C.J., Sato H., Fonseca C. et al. Mucin 5B promoter polymorphism is associated with idiopathic pulmonary fibrosis but not with development of lung fibrosis in systemic sclerosis or sarcoidosis. Thorax 2013; 68 (5): 436 - 441.
12. El-Chemaly S., Ziegler S.G., Calado R.T. et al. Natural history of pulmonary fibrosis in two subjects with the same telomerase mutation. Chest 2011; 139 (5): 1203 - 1209.
13. Tsang A.R., Wyatt H.D., Ting N.S. et al. hTERT mutations associated with idiopathic pulmonary fibrosis affect telomerase activity, telomere length, and cell growth by distinct mechanisms. Aging Cell 2012; 11 (3): 482 - 490.
14. Fukuhara A., Tanino Y., Ishii T. et.al. Pulmonary fibrosis in dyskeratosis congenita with TINF2 gene mutation. Eur Respir J 2013; 42 (6): 1757 - 1759.
15. Kropski J.A., Mitchell D.B., Markin C. et al. A novel dyskerin (DKC1) mutation is associated with familial interstitial pneumonia. Chest 2014; 146 (1): e1 - e7.
16. Alder J.K., Stanley S.E., Wagner C.L. et al. Exome sequencing identifies mutant TINF2 in a family with pulmonary fibrosis. Chest 2015; 147 (5): 1361 - 1368.
17. Чучалин А.Г., Авдеев С.Н., Айсанов З.Р., Белевский А.С., Демура С.А., Илькович М.М., Коган Е.А., Самсонова М.В., Сперанская А.А., Тюрин И.Е., Черняев А.Л., Черняк Б.А., Черняк А.В., Шмелев Е.И. Диагностика и лечение идиопатического легочного фиброза. Федеральные клинические рекомендации. Пульмонология 2016; 26 (N 4): 399 - 419.
18. Raghu G., Chen S., Yeh W., Maroni B., Li Q., Lee Y., et al. Idiopathic pulmonary fibrosis in US Medicare beneficiaries aged 65 years and older: incidence, prevalence, and survival, 2001 - 11. Lancet Respir Med 2014; 2: 566 - 572.
19. Raghu G., Weycker D., Edelsberg J. et al. Incidence and prevalence of idiopathic pulmonary fibrosis. Am J Respir Crit Care Med 2006; 174: 810 - 816.
20. Coultas D.B., Zumwalt R.E., Black W.C., Sobonya R.E. The epidemiology of interstitial lung diseases. Am J Respir Crit Care Med 1994; 150: 967 - 972.
21. Nalysnyk L., Cid-Ruzafa J., Rotella P. et al. Incidence and prevalence of idiopathic pulmonary fibrosis: review of the literature. Eur Respir Rev 2012; 21: 355 - 361.
22. Richeldi L, Rubin A, Avdeev S, Udwadia ZF, Xu ZJ. Idiopathic pulmonary fibrosis in BRIC countries: the cases of Brazil, Russia, India, and China. BMC Medicine 2015; 13: 237.
23. Raghu G., Remy-Jardin M., Myers J.L. et al. Diagnosis of Idiopathic Pulmonary Fibrosis. An Official ATS/ERS/JRS/ALAT Clinical Practice Guideline. Am J Respir Crit Care Med 2018; 198 (5): e44 - e68.
24. Lynch D.A., Sverzellati N., Travis W.D. et al. Diagnostic criteria for idiopathic pulmonary fibrosis: a Fleischner Society White Paper. Lancet Respir Med. 2018; 6 (2): 138 - 153.
25. George R.B., Light R.W., Mattay M.A., Mattay R.A. (eds.). Chest Medicine: Essentials Of Pulmonary And Critical Care Medicine. 5-th edition, LWW, 2005; 238 - 244.
26. Collard H.R., Ryerson C.J., Corte T.J. et al. Acute exacerbation of idiopathic pulmonary fibrosis: an international working group report. Am J Respir Crit Care Med, 2016; 194: 265 - 275.
27. Gross T.J., Hunninghake G.W. Idiopathic pulmonary fibrosis. N Engl J Med 2001; 345: 517 - 525.
28. King T.E., Tooze J.A., Schwarz M.I. et al. Predicting survival in idiopathic pulmonary fibrosis: scoring system and survival model. Am J Respir Crit Care Med 2001; 164: 1171 - 118.
29. Авдеев С.Н. Обострение идиопатического легочного фиброза. Пульмонология 2018; 28(4): 469 - 482. DOI: 10.18093/0869-0189-2018-28-4-469-482.
30. Ambrosini V., Cancellieri A., Chilosi M. et al. Acute exacerbation of idiopathic pulmonary fibrosis: report of a series. Eur Respir J 2003; 22: 821 - 826.
31. Kim D.S., Park J.H., Park B.K. et al. Acute exacerbation of idiopathic pulmonary fibrosis: frequency and clinical features. Eur Respir J 2006; 27: 143 - 150.
32. Rajala K., J.T. Lehto, Sutinen E., Kautiainen H.,  M., Saarto T. mMRC dyspnoea scale indicates impaired quality of life and increased pain in patients with idiopathic pulmonary fibrosis//ERJ Open Research Oct 2017, 3 (4) 00084-2017; DOI: 10.1183/23120541.00084-2017.
M., Saarto T. mMRC dyspnoea scale indicates impaired quality of life and increased pain in patients with idiopathic pulmonary fibrosis//ERJ Open Research Oct 2017, 3 (4) 00084-2017; DOI: 10.1183/23120541.00084-2017.
33. Ley B., Ryerson C.J., Vittinghoff E., Ryu J.H., Tomassetti S., Lee J.S., Poletti V., Buccioli M., Elicker B.M., Jones K.D., King T.E. Jr., Collard H.R. A multidimensional index and staging system for idiopathic pulmonary fibrosis. Ann Intern Med. 2012 May 15; 156 (10): 684 - 91. doi: 10.7326/0003-4819-156-10-201205150-00004.
34. Sgalla G., Walsh S.L.F., Sverzellati N. et al. "Velcro-type" crackles predict specific radiologic features of fibrotic interstitial lung disease. BMC Pulm Med. 2018; 18 (1): 103. doi: 10.1186/s12890-018-0670-0.
35. Collard H.R., King T.E. Jr, Bartelson B.B. et al. Changes in clinical and physiologic variables predict survival in idiopathic pulmonary fibrosis. Am J Respir Crit Care Med 2003; 168: 538 - 542.
36. Wells A.U., Desai S.R., Rubens M.B. et al. Idiopathic pulmonary fibrosis: a composite physiologic index derived from disease extent observed by computed tomography. Am J Respir Crit Care Med 2003; 167: 962 - 969.
37. Mathieson J.R., Mayo J.R., Staples C.A., Muller N.L. Chronic diffuse infiltrative lung disease: comparison of diagnostic accuracy of CT and chest radiography. Radiology 1989; 171: 111 - 116.
38. Remy-Jardin M., Campistron P., Amara A. et al. Usefulness of coronal reformations in the diagnostic evaluation of infiltrative lung disease. J Comput Assist Tomogr 2003; 27: 266 - 273.
39. Bankier A.A., O'Donnell C.R., Boiselle P.M. Quality initiatives. Respiratory instructions for CT examinations of the lungs: a hands- on guide. Radiographics 2008; 28: 919 - 931.
40. Kim M., Lee S.M., Song J.W. et al. Added value of prone CT in the assessment of honeycombing and classification of usual interstitial pneumonia pattern. Eur J Radiol 2017; 91: 66 - 70.
41. Gotway M.B., Lee E.S., Reddy G.P. et al. Low-dose, dynamic, expiratory thin-section CT of the lungs using a spiral CT scanner. J Thorac Imaging 2000; 15: 168 - 172.
42. Lynch D.A., Godwin J.D., Safrin S. et al. High-resolution computed tomography in idiopathic pulmonary fibrosis: diagnosis and prognosis. Am J Respir Crit Care Med 2005; 172: 488 - 493.
43. Remy-Jardin M., Giraud F., Remy J. et al. Importance of ground-glass attenuation in chronic diffuse infiltrative lung disease: pathologic-CT correlation. Radiology 1993; 189: 693 - 698.
44. Silva C.I., ![]() N.L., Lynch D.A. et al. Chronic hypersensitivity pneumonitis: differentiation from idiopathic pulmonary fibrosis and nonspecific interstitial pneumonia by using thin-section CT. Radiology 2008; 246: 288 - 297.
N.L., Lynch D.A. et al. Chronic hypersensitivity pneumonitis: differentiation from idiopathic pulmonary fibrosis and nonspecific interstitial pneumonia by using thin-section CT. Radiology 2008; 246: 288 - 297.
45. Raghu G., Mageto Y.N., Lockhart D. et al. The accuracy of the clinical diagnosis of new-onset idiopathic pulmonary fibrosis and other interstitial lung disease: a prospective study. Chest 1999; 116: 1168 - 1174.
46. Chung J.H., Chawla A., Peljto A.L. et al. CT scan findings of probable usual interstitial pneumonitis have a high predictive value for histologic usual interstitial pneumonitis. Chest 2015; 147: 450 - 459.
47. Cottin V., Nunes H., Brillet P.Y. et al. Combined pulmonary fibrosis and emphysema: a distinct underrecognised entity. Eur Respir J 2005; 26: 586 - 593.
48. Behr J., Kreuter M., Hoeper M.M. et al. Management of patients with idiopathic pulmonary fibrosis in clinical practice: the INSIGHTS-IPF registry. Eur Respir J 2015; 46: 186 - 196.
49. Akagi T, Matsumoto T, Harada T, et al. Coexistent emphysema delays the decrease of vital capacity in idiopathic pulmonary fibrosis. Respir Med 2009; 103: 1209 - 1215.
50. Enright P.L. The six-minute walk test. Respir Care 2003; 48: 783 - 785.
51. Lama V.N., Flaherty K.R., Toews G.B. et al. Prognostic value of desaturation during a 6-minute walk test in idiopathic interstitial pneumonia. Am J Respir Crit Care Med 2003; 168: 1084 - 1090.
52. du Bois R.M., Weycker D., Albera C. et al. Forced vital capacity in patients with idiopathic pulmonary fibrosis: test properties and minimal clinically important difference. Am J Respir Crit Care Med 2011; 184: 1382 - 1389.
53. Caminati A., Bianchi A., Cassandro R. et al. Walking distance on 6-MWT is a prognostic factor in idiopathic pulmonary fibrosis. Respir Med 2009; 103: 117 - 123.
54. Lederer D.J., Arcasoy S.M., Wilt J.S. et al. Six-minute-walk distance predicts waiting list survival in idiopathic pulmonary fibrosis. Am J Respir Crit Care Med 2006; 174: 659 - 664.
55. Dowman L., Hill C.J., Holland A.E. Pulmonary rehabilitation for interstitial lung disease. Cochrane Database Syst Rev 2014; 10: CD006322.
56. Mapel D.W., Samet J.M., Coultas D.B. Corticosteroids and the treatment of idiopathic pulmonary fibrosis. Past, present, and future. Chest 1996; 110 (4): 1058 - 1067.
57. Hanson D., Winterbauer R.H., Kirtland S.H., Wu R. Changes in pulmonary function test results after 1 year of therapy as predictors of survival in patients with idiopathic pulmonary fibrosis. Chest 1995; 108 (2): 305 - 310.
58. Douglas W.W., Ryu J.H., Schroeder D.R. Idiopathic pulmonary fibrosis: impact of oxygen and colchicine, prednisone, or no therapy on survival. Am J Respir Crit Care Med 2000; 161 (4 I): 1172 - 1178.
59. Raghu G., Depaso W.J., Cain K. et al. Azathioprine combined with prednisone in the treatment of idiopathic pulmonary fibrosis: a prospective double-blind, randomized, placebo-controlled clinical trial. Am Rev Respir Dis 1991; 144 (2): 291 - 296.
60. Flaherty K.R., Toews G.B., Lynch J.P. et al. Steroids in idiopathic pulmonary fibrosis: a prospective assessment of adverse reactions, response to therapy, and survival. Am J Med 2001; 110: 278 - 282.
61. Martinez F.J., Arbor A., Cornell W. et al. Randomized trial of acetylcysteine in idiopathic pulmonary fibrosis. N Engl J Med 2014; 370: 2093 - 2101.
62. Behr J., Maier K., Degenkolb B. et al. Antioxidative and clinical effects of high-dose N-acetylcysteine in fibrosing alveolitis: adjunctive therapy to maintenance immunosuppression. Am J Respir Crit Care Med 1997; 156: 1897 - 1901.
63. Tomioka H., Kuwata Y., Imanaka K. et al. A pilot study of aerosolized N-acetylcysteine for idiopathic pulmonary fibrosis. Respirology 2005; 10: 449 - 455.
64. Oldham J.M., Ma S.-F., Martinez F.J. et al. TOLLIP, MUC5B, and the Response to N-Acetylcysteine among Inpiduals with Idiopathic Pulmonary Fibrosis. Am J Respir Crit Care Med 2015; 192: 1475 - 1482.
65. Demedts M., Behr J., Buhl R. et al. IFIGENIA Study Group. High-dose acetylcysteine in idiopathic pulmonary fibrosis. N Engl J Med 2005; 353: 2229 - 2242.
66. Raghu G., Anstrom K.J., King T.E. Jr. et al. Prednisone, azathioprine, and N-acetylcysteine for pulmonary fibrosis. N Engl J Med 2012; 366: 1968 - 1977.
67. Raghu G,. Behr J., Brown K.K. et al. Treatment of idiopathic pulmonary fibrosis with ambrisentan: a parallel, randomized trial. Ann Intern Med. 2013; 158 (9): 641 - 9. doi: 10.7326/0003-4819-158-9-201305070-00003.
68. Noth I., Anstrom K.J., Calvert S.B. et al. A placebo-controlled randomized trial of warfarin in idiopathic pulmonary fibrosis. Am J Respir Crit Care Med 2012; 186: 88 - 95.
69. Lee J.S., Collard H.R., Anstrom K.J. et al. Anti-acid treatment and disease progression in idiopathic pulmonary fibrosis: an analysis of data from three randomised controlled trials. Lancet Respir Med 2013; 1 (5): 369 - 376.
70. Tran T., Suissa S. The effect of anti-acid therapy on survival in idiopathic pulmonary fibrosis: a methodological review of observational studies. Eur Respir J 2018; 51: 1800376. Di Mar.
71. Di Martino E., Provenzani A., Vitulo P., Polidori P. Systematic Review and Meta-analysis of Pirfenidone, Nintedanib, and Pamrevlumab for the Treatment of Idiopathic Pulmonary Fibrosis. Ann Pharmacother 2021; 55 (6): 723 - 731. doi: 10.1177/1060028020964451.
72. Lancaster L., Crestani B., Hernandez P. et al. Safety and survival data in patients with idiopathic pulmonary fibrosis treated with nintedanib: pooled data from six clinical trials. BMJ Open Respir Res 2019; 6 (1): e000397. doi: 10.1136/bmjresp-2018-000397.
73. Skandamis A., Kani C., Markantonis S.L., Souliotis K. Systematic review and network meta-analysis of approved medicines for the treatment of idiopathic pulmonary fibrosis. J Drug Assess. 2019; 8 (1): 55 - 61. doi: 10.1080/21556660.2019.1597726.
74. Richeldi L., Costabel U., Selman M. et al. Efficacy of a tyrosine kinase inhibitor in idiopathic pulmonary fibrosis. N Engl J Med 2011; 365 (12): 1079 - 1087.
75. Richeldi L., du Bois R.M., Raghu G. et al. Efficacy and safety of nintedanib in idiopathic pulmonary fibrosis. N Engl J Med 2014; 370 (22): 2071 - 2082.
76. Crestani B., Huggins J.T., Kaye M. et al. Long-term safety and tolerability of nintedanib in patients with idiopathic pulmonary fibrosis: results from the open-label extension study, INPULSIS-ON. Lancet Respir Med 2019; 7 (1): 60 - 68.
77. Richeldi L., Cottin V., du Bois R.M. et al. Nintedanib in patients with idiopathic pulmonary fibrosis: combined evidence from the TOMORROW and INPULSIS Trials. Respir Med 2016; 113: 75 - 79.
78. Авдеев С.Н. Новые возможности терапии идиопатического легочного фиброза. Пульмонология 2017; 27 (N 4): 502 - 514.
79. Авдеев С.Н., Трушенко Н.В. Антифибротическая терапия идиопатического легочного фиброза. Медицинский Совет 2018; N 15: 131 - 136.
80. Noble P.W., Albera C., Bradford W.Z. et al. Pirfenidone in patients with idiopathic pulmonary fibrosis (CAPACITY): two randomised trials. Lancet. 2011; 377 (9779): 1760 - 1769.
81. King T.E., Bradford W.Z., Castro-Bernardini S. et al. A phase 3 trial of pirfenidone in patients with idiopathic pulmonary fibrosis. N Engl J Med 2014; 370 (22): 2083 - 2092.
82. Nathan S.D., Albera C., Bradford W.Z. et al. Effect of pirfenidone on mortality: pooled analyses and meta-analyses of clinical trials in idiopathic pulmonary fibrosis. Lancet Respir Med 2017; 5 (1): 33 - 41.
83. Richeldi L., Cottin V., Flaherty K.R.et al. Design of the INPULSIS trials: Two phase 3 trials of nintedanib in patients with idiopathic pulmonary fibrosis. Respiratory Medicine 2014; 108 (7): 1023 - 1030. https://doi.org/10.1016/j.rmed.2014.04.011.
84. Nathan S.D., Costabel U., Albera C. et al. Pirfenidone in patients with idiopathic pulmonary fibrosis and more advanced lung function impairment. Respir Med. 2019; 153: 44 - 51. doi: 10.1016/j.rmed.2019.04.016.
85. Birring S.S., Kavanagh J.E., Irwin R.S. et al. Treatment of Interstitial Lung Disease associated cough: CHEST guideline and expert panel report. Chest 2018; 154 (4): 904 - 917.
86. Nocturnal Oxygen Therapy Trial Group. Continuous or nocturnal oxygen therapy in hypoxemic chronic obstructive lung disease: a clinical trial. Ann Intern Med 1980; 93: 391 - 398.
87. Long-term domiciliary oxygen therapy in chronic hypoxic cor pulmonale complicating chronic bronchitis and emphysema: report of the Medical Research Council Working Party. Lancet 1981; 1: 681 - 686.
88. Faverio P., De Giacomi F., Sardella L. et al. Management of acute respiratory failure in interstitial lung diseases: overview and clinical insights. BMC Pulm Med. 2018; 18 (1): 70. doi: 10.1186/s12890-018-0643-3.
89. Dreher M., Ekkernkamp E., Schmoor C. et al. Pulmonary rehabilitation and noninvasive ventilation in patients with hypercapnic interstitial lung disease. Respiration. 2015; 89 (3): 208 - 13. doi: 10.1159/000369862.
90. Stern J.B., Mal H., Groussard O. et al. Prognosis of patients with advanced idiopathic pulmonary fibrosis requiring mechanical ventilation for acute respiratory failure. Chest 2001; 120: 213 - 219.
91. Al-Hameed F.M., Sharma S. Outcome of patients admitted to the intensive care unit for acute exacerbation of idiopathic pulmonary fibrosis. Can Respir J 2004; 11: 117 - 122.
92. Mollica C., Paone G., Conti V. et al. Mechanical ventilation in patients with end-stage idiopathic pulmonary fibrosis. Respiration 2010; 79: 209 - 215.
93. Thabut G., Mal H., Castier Y. et al. Survival benefit of lung transplantation for patients with idiopathic pulmonary fibrosis. J Thorac Cardiovasc Surg 2003; 126: 469 - 475.
94. Hanada M., Kasawara K.T., Mathur S., Rozenberg D. et al. Aerobic and breathing exercises improve dyspnea, exercise capacity and quality of life in idiopathic pulmonary fibrosis patients: systematic review and meta-analysis. J Thorac Dis 2020; 12 (3): 1041 - 1055. doi: 10.21037/jtd.2019.12.27.
95. King T.E. Jr, Safrin S., Starko K.M. et al. Analyses of efficacy end points in a controlled trial of interferon-gamma1b for idiopathic pulmonary fibrosis. Chest 2005; 127: 171 - 177.
96. Zappala C.J., Latsi P.I., Nicholson A.G. et al. Marginal decline in forced vital capacity is associated with a poor outcome in idiopathic pulmonary fibrosis. Eur Respir J 2010; 35: 830 - 836.
97.  M., Sitek P., Ziora D. Idiopathic pulmonary fibrosis coexisting with lung cancer - a review. Adv Respir Med 2018; 86 (6): 319 - 326.
M., Sitek P., Ziora D. Idiopathic pulmonary fibrosis coexisting with lung cancer - a review. Adv Respir Med 2018; 86 (6): 319 - 326.
98. Karampitsakos T., Tzilas V., Tringidou R. et al. Lung cancer in patients with idiopathic pulmonary fibrosis. Pulm Pharmacol Ther 2017; 45: 1 - 10.
99. Vancheri C. Cancer. In: Costabel U., Crestani B., Wells A. Idiopathic Pulmonary Fibrosis. ERS monograph, 2016, 71: 151 - 158.
100. Ghofrani H.A., Wiedemann R., Rose F. et al. Sildenafil for treatment of lung fibrosis and pulmonary hypertension: a randomised controlled trial. Lancet 2002; 360: 895 - 900.
101. Madden B.P., Allenby M., Loke T., Sheth A. A potential role for sildenafil in the management of pulmonary hypertension in patients with parenchymal lung disease. Vascul Pharmacol 2006; 44: 372 - 376.
102. Collard H.R., Anstrom K.J., Schwarz M.I., Zisman DA. Sildenafil improves walk distance in idiopathic pulmonary fibrosis. Chest 2007; 131: 897 - 899.
103. Olschewski H., Ghofrani H.A., Walmrath D. et al. Inhaled prostacyclin and iloprost in severe pulmonary hypertension secondary to lung fibrosis. Am J Respir Crit Care Med 1999; 160: 600 - 607.
104. Minai O.A., Sahoo D., Chapman J.T., Mehta A.C. Vaso-active therapy can improve 6-min walk distance in patients with pulmonary hypertension and fibrotic interstitial lung disease. Respir Med 2008; 102: 1015 - 1020.
105. Fulton B.G., Ryerson C.J. Managing comorbidities in idiopathic pulmonary fibrosis. International Journal of General Medicine 2015: 8: 309 - 318.
106. Raghu G., Yang S.T., Spada C., et al. Sole treatment of acid gastroesophageal reflux in idiopathic pulmonary fibrosis: a case series. Chest 2006; 129: 794 - 800.
107. Linden P.A., Gilbert R.J., Yeap B.Y., et al. Laparoscopic fundoplication in patients with end-stage lung disease awaiting transplantation. J Thorac Cardiovasc Surg 2006; 131: 438 - 446.
108. Lee J.S., Ryu J.H., Elicker B.M., et al. Gastroesophageal reflux therapy is associated with longer survival in idiopathic pulmonary fibrosis. Am J Respir Crit Care Med 2011; 184: 1390 - 1394.
109. Savarino E., Bazzica M., Zentilin P., et al. Gastroesophageal reflux and pulmonary fibrosis in scleroderma: a study using pH-impedance monitoring. Am J Respir Crit Care Med 2009; 179: 408 - 413.
110.  E.,
E., 
 F., Peloche G.B. Comorbidities and complications in idiopathic pulmonary fibrosis. Med Sci 2018; 6: 71.
F., Peloche G.B. Comorbidities and complications in idiopathic pulmonary fibrosis. Med Sci 2018; 6: 71.
111. Kreuter M., Brunnemer E., Ehlers-Tenenbaum S. et a. Other comorbidities. In: Costabel U., Crestani B., Wells A. Idiopathic Pulmonary Fibrosis. ERS monograph, 2016, 71: 174 - 185.
Приложение А1
СОСТАВ
РАБОЧЕЙ ГРУППЫ ПО РАЗРАБОТКЕ И ПЕРЕСМОТРУ
КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ
1
Авдеев С.Н.
Заведующий кафедрой пульмонологии Федерального государственного автономного образовательного учреждения высшего образования "Первый Московский государственный медицинский университет имени И.М. Сеченова" Министерства здравоохранения Российской Федерации (Сеченовский Университет); заведующий клиническим отделом, заместитель директора по научной работе, ФГБУ "НИИ пульмонологии" ФМБА России, член-корреспондент РАН, профессор, д.м.н.
2
Айсанов З.Р.
Профессор кафедры пульмонологии Федерального государственного бюджетного образовательного учреждения высшего образования "Российский национальный исследовательский медицинский университет имени Н.И. Пирогова" Министерства здравоохранения Российской Федерации, д.м.н.
3
Белевский А.С.
Заведующий кафедрой пульмонологии РНИМУ им. Н.И. Пирогова, профессор, д.м.н.
4
Коган Е.А.
Заведующая кафедрой патологической анатомии имени А.И. Струкова Федерального государственного автономного образовательного учреждения высшего образования "Первый Московский государственный медицинский университет имени И.М. Сеченова" Министерства здравоохранения Российской Федерации (Сеченовский Университет); д.м.н., профессор
5
Мержоева З.М.
Ассистент кафедры пульмонологии Федерального государственного автономного образовательного учреждения высшего образования "Первый Московский государственный медицинский университет имени И.М. Сеченова" Министерства здравоохранения Российской Федерации (Сеченовский Университет); к.м.н.
6
Петров Д.В.
Врач-пульмонолог Поликлиники N 1 Бюджетного учреждения здравоохранения Омской области "Городская клиническая больница N 1 им. Кабанова А.Н."
7
Самсонова М.В.
Заведующая лабораторией патологической анатомии и иммунологии ФГБУ "НИИ пульмонологии" ФМБА России, д.м.н.
8
Терпигорев С.А.
Руководитель отделения профпатологии и ВТЭ, профессор кафедры терапии ФУВ Государственного бюджетного учреждения здравоохранения Московской области Московский областной научно-исследовательский клинический институт имени М.Ф. Владимирского, д.м.н.
9
Трушенко Н.В.
Ассистент кафедры пульмонологии Федерального государственного автономного образовательного учреждения высшего образования "Первый Московский государственный медицинский университет имени И.М. Сеченова" Министерства здравоохранения Российской Федерации (Сеченовский Университет); научный сотрудник ФГБУ "НИИ пульмонологии" ФМБА России, к.м.н.
10
Трофименко И.Н.
зав. кафедрой клинической аллергологии и пульмонологии ИГМАПО филиал ФГБОУ ДПО РМАНПО Минздрава России, д.м.н., доцент
11
Тюрин И.Е.
Заведующий кафедрой рентгенологии и радиологии ГБОУ ДПО "Российская медицинская академия последипломного образования" Министерства здравоохранения РФ, главный внештатный специалист по лучевой диагностике Минздрава РФ, профессор, д.м.н.
12
Черняев А.Л.
Заведующий отделом патологии ФГБУ "НИИ пульмонологии" ФМБА России, профессор, д.м.н.
13
Черняк Б.А.
Заведующий кафедрой клинической аллергологии и пульмонологии ГБОУ ДПО "Иркутская медицинская академия последипломного образования", профессор, д.м.н.
14
Черняк А.В.
Заведующий лабораторией функциональных и ультразвуковых методов исследования ФГБУ "НИИ пульмонологии" ФМБА России, к.м.н.
15
Чикина С.Ю.
Ассистент кафедры пульмонологии Федерального государственного автономного образовательного учреждения высшего образования "Первый Московский государственный медицинский университет имени И.М. Сеченова" Министерства здравоохранения Российской Федерации (Сеченовский Университет); к.м.н.
16
Шмелев Е.И.
Заведующий отделом дифференциальной диагностики ЦНИИТ РАМН, профессор, д.м.н., заслуженный деятель науки РФ
Конфликт интересов:
Никто из членов рабочей группы не имеет конфликта интересов, связанного с разработкой и внедрением в клиническую практику данных клинических рекомендаций.
Приложение А2
МЕТОДОЛОГИЯ РАЗРАБОТКИ КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ
Методы, использованные для сбора/селекции доказательств:
поиск в электронных базах данных.
Описание методов, использованных для сбора/селекции доказательств:
доказательной базой для рекомендаций являются публикации, вошедшие в Кокрановскую библиотеку, базы данных EMBASE и MEDLINE. Глубина поиска составляла 10 лет.
Методы, использованные для оценки качества и силы доказательств:
- Консенсус экспертов;
- Оценка значимости в соответствии с рейтинговой схемой.
Целевая аудитория данных клинических рекомендаций:
1. Врачи-терапевты
2. Врачи общей практики (семейные врачи)
3. Врачи-пульмонологи
4. Врачи-рентгенологи
5. Врачи-патологоанатомы
6. Врачи по медицинской реабилитации
Таблица 1. Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств)
УДД
Расшифровка
1
Систематические обзоры исследований с контролем референсным методом или систематический обзор рандомизированных клинических исследований с применением метаанализа
2
Отдельные исследования с контролем референсным методом или отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением метаанализа
3
Исследования без последовательного контроля референсным методом или исследования с референсным методом, не являющимся независимым от исследуемого метода или нерандомизированные сравнительные исследования, в том числе когортные исследования
4
Несравнительные исследования, описание клинического случая
5
Имеется лишь обоснование механизма действия или мнение экспертов
Таблица 2. Шкала оценки уровней достоверности доказательств (УДД) для методов профилактики, лечения и реабилитации (профилактических, лечебных, реабилитационных вмешательств)
УДД
Расшифровка
1
Систематический обзор РКИ с применением метаанализа
2
Отдельные РКИ и систематические обзоры исследований любого дизайна, за исключением РКИ, с применением метаанализа
3
Нерандомизированные сравнительные исследования, в т.ч. когортные исследования
4
Несравнительные исследования, описание клинического случая или серии случаев, исследования "случай-контроль"
5
Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов
Таблица 3. Шкала оценки уровней убедительности рекомендаций (УУР) для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств)
УУР
Расшифровка
A
Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными)
B
Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными)
C
Слабая рекомендация (отсутствие доказательств надлежащего качества (все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными)
Порядок обновления клинических рекомендаций.
Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию - не реже чем один раз в три года, а также при появлении новых данных с позиции доказательной медицины по вопросам диагностики, лечения, профилактики и реабилитации конкретных заболеваний, наличии обоснованных дополнений/замечаний к ранее утвержденным КР, но не чаще 1 раза в 6 месяцев.
Приложение А3
СПРАВОЧНЫЕ МАТЕРИАЛЫ,
ВКЛЮЧАЯ СООТВЕТСТВИЕ ПОКАЗАНИЙ К ПРИМЕНЕНИЮ
И ПРОТИВОПОКАЗАНИЙ, СПОСОБОВ ПРИМЕНЕНИЯ И ДОЗ
ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ, ИНСТРУКЦИИ ПО ПРИМЕНЕНИЮ
ЛЕКАРСТВЕННОГО ПРЕПАРАТА
1. Чучалин А.Г., Авдеев С.Н., Айсанов З.Р., Белевский А.С., Демура С.А., Илькович М.М., Коган Е.А., Самсонова М.В., Сперанская А.А., Тюрин И.Е., Черняев А.Л., Черняк Б.А., Черняк А.В., Шмелев Е.И. Диагностика и лечение идиопатического легочного фиброза. Федеральные клинические рекомендации. Пульмонология 2016; 26 (N 4): 399 - 419.
2. Идиопатический легочный фиброз. Клинические рекомендации./Доступно по ссылке: https://spulmo.ru/obrazovatelnye-resursy/federalnye-klinicheskie-rekomendatsii/Idiopathic Pulmonary Fibrosis. Clinical Guideline. Available at: https://spulmo.ru/obrazovatelnye-resursy/federalnye-klinicheskie-rekomendatsii/
3. Инструкция по медицинскому применению препарата Варгатеф(R)/электронный ресурс/Доступно по ссылке: http://grls.rosminzdrav.ru/Grls_View_v2.aspx?routingGuid=89d81e79-6176-4356-8184-1cd22b600c7a&t= дата последней проверки 19.03.2021/Vargatef. Prescription Drug Leaflet. Available at: http://grls.rosminzdrav.ru/Grls_View_v2.aspx?routingGuid=89d81e79-6176-4356-8184-1cd22b600c7a&t=. Accessed on 19.03.2021.
Приложение Б
АЛГОРИТМЫ ДЕЙСТВИЙ ВРАЧА

Приложение В
ИНФОРМАЦИЯ ДЛЯ ПАЦИЕНТА
Идиопатический легочный фиброз - заболевание легких, при котором происходит повреждение и утолщение стенок легочных альвеол. Альвеолы - это маленькие "мешочки", через стенки которых кислород из воздуха проникает в кровь. При поражении альвеол легочная ткань уплотняется (фиброзируется), что приводит к необратимому прогрессирующему снижению функции легких. Синонимами идиопатического легочного фиброза являются: идиопатический фиброзирующий альвеолит, фиброзирующий альвеолит. Как правило, заболевание возникает в возрасте старше 40 лет. К сожалению, до сих пор причина этой болезни не известна.
У кого может возникнуть идиопатический легочный фиброз?
В группе риска находятся:
- курильщики;
- люди, работающие во вредных производственных условиях;
- пациенты с отягощенной наследственностью (если идиопатический легочный фиброз есть у близких родственников).
Симптомы идиопатического легочного фиброза
Как правило, заболевание начинается медленно и незаметно для больного. Для идиопатического легочного фиброза характерны следующие симптомы:
- одышка при физической нагрузке (сначала при большой нагрузке, затем и в покое).
- сухой кашель;
- утомляемость;
- головокружение;
- тревога;
- снижение веса.
Для подтверждения диагноза врач обязательно должен исключить заболевания легких с известной причиной, которые могут также проявляться кашлем и нарастающей одышкой. Если в результате тщательного обследования причина этих симптомов не найдена, то заболевание считают идиопатическим (неизвестной природы).
При подозрении на идиопатический легочный фиброз минимальный план обследования включает:
- анализ крови;
- исследование функции внешнего дыхания (спирография, а при возможности - бодиплетизмография и исследование диффузионной способности легких), которая помогает более точно определить причину одышки, которая может сопровождать и другие заболевания легких;
- компьютерную томографию легких. В настоящее время компьютерная томография легких является одним из самых точных методов диагностики идиопатического легочного фиброза.
Если после тщательного расспроса, осмотра и проведенных исследований у врача остаются сомнения в диагнозе, то проводится биопсия легких. Биопсия - процедура, при которой хирург оперативным путем получает маленький фрагмент ткани (в данном случае - легочной ткани). Затем полученный образец под микроскопом исследует врач-патологоанатом для того, чтобы найти признаки конкретного заболевания.
Лечение идиопатического легочного фиброза
К лекарственным препаратам для лечения ИЛФ с доказанной эффективностью относятся только два: нинтеданиб** и пирфенидон**. Данные препараты позволяют приостановить прогрессирование заболевания и, возможно, продлить жизнь пациента. При быстром ухудшении самочувствия, внезапном нарастании одышки необходимо срочно обратиться к Вашему доктору. Такая ситуация часто требует госпитализации в больницу. Для профилактики обострений Ваш лечащий доктор может рекомендовать противогриппозную вакцинацию 1 раз в год и однократную противопневмококковую вакцинацию (для профилактики развития пневмонии).
Самым эффективным способом лечения идиопатического легочного фиброза является трансплантация легких - хирургическая операция по замене поврежденных легких на легкие здорового донора.
При идиопатическом легочном фиброзе больному необходимо:
- обязательно прекратить курение (в том числе пассивное), т.к. оно способствует прогрессированию болезни;
- участвовать в программах легочной реабилитации. Инструктор лечебной физкультуры расскажет Вам о различных дыхательных упражнениях, которые способствуют уменьшению одышки и общей слабости;
- при наличии гастроэзофагеальной рефлюксной болезни лечить это заболевание. Гастроэзофагеальная (желудочно-пищеводная) рефлюксная болезнь - заболевание, при котором происходит заброс небольшого количества кислого содержимого желудка в пищевод и затем в дыхательные пути. Доказано, что это заболевание способствует прогрессированию идиопатического легочного фиброза. Лечение гастроэзофагеальной рефлюксной болезни поможет уменьшить повреждение легких при идиопатическом легочном фиброзе;
- регулярно принимать лекарственные препараты, которые назначил Ваш лечащий врач. В последние годы ведется активная разработка новых препаратов для лечения больных идиопатическим легочным фиброзом. Узнайте у своего лечащего врача о возможности наблюдения и лечения в крупном научно-исследовательском учреждении, где могут быть доступны современные препараты;
- проводить длительную кислородотерапию. При идиопатическом легочном фиброзе со временем развивается гипоксемия (низкое содержание кислорода в крови), которое корректируется длительной ингаляцией кислорода из концентратора.
Приложение Г1 - ГN
ШКАЛЫ ОЦЕНКИ, ВОПРОСНИКИ И ДРУГИЕ ОЦЕНОЧНЫЕ ИНСТРУМЕНТЫ
СОСТОЯНИЯ ПАЦИЕНТА, ПРИВЕДЕННЫЕ В КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЯХ
Г1. Шкала Медицинского Исследовательского Совета Великобритании (Medical Research Council) (шкала MRC)
Источник: Mahler DA, Wells CK. Evaluation of clinical methods for rating dyspnea. Chest. 1988 Mar; 93 (3): 580 - 6. doi: 10.1378/chest.93.3.580. PMID: 3342669.
Тип (подчеркнуть):
- шкала оценки
- индекс
- 
- другое (уточнить):
Назначение: оценка тяжести одышки при повседневной физической активности
Содержание (шаблон):
Балл
Тяжесть
Описание
0
Нет
Одышка не беспокоит, за исключением очень интенсивной нагрузки
1
Легкая
Одышка при быстрой ходьбе или подъеме на небольшую возвышенность
2
Средняя
Одышка заставляет идти медленнее по сравнению с другими людьми того же возраста либо необходимо останавливаться при ходьбе в своем темпе по ровной местности
3
Тяжелая
Необходимо останавливаться из-за одышки через 100 м или через несколько минут спокойной ходьбы по ровной местности
4
Очень тяжелая
Одышка не позволяет выходить из дома либо появляется при одевании и раздевании
Ключ (интерпретация): более высокий балл соответствует более тяжелой одышке при повседневной физической активности
Пояснения: шкала MRC используется для исходной оценки клинического статуса пациента и мониторирования его состояния на фоне лечения.
Г2. Шкала GAP
Источник: Ley B., Ryerson C.J., Vittinghoff E., Ryu J.H., Tomassetti S., Lee J.S., Poletti V., Buccioli M., Elicker B.M., Jones K.D., King T.E. Jr., Collard H.R. A multidimensional index and staging system for idiopathic pulmonary fibrosis. Ann Intern Med. 2012 May 15; 156 (10): 684 - 91. doi: 10.7326/0003-4819-156-10-201205150-00004.
Тип (подчеркнуть):
- шкала оценки
- 
- вопросник
- другое (уточнить):
Назначение: оценка тяжести и прогноза течения ИЛФ
Содержание (шаблон):
Предикторы
Баллы
G
Пол
Женщины
0
Мужчины
1
A
Возраст, лет
![]()
0
61 - 65
1
>= 65
2
P
Физиология
ФЖЕЛ, % должн.
> 75
0
50 - 75
1
< 50
2
DLCO, % должн.
> 55
0
36 - 55
1
![]()
2
Не могут выполнить
3
Ключ (интерпретация): более высокий балл соответствует более тяжелому течению и более неблагоприятному прогнозу ИЛФ. Общий балл (диапазон от 0 до 8) используется для классификации пациентов на I стадию (0 - 3 балла), II стадию (4 - 5 баллов) или III стадию (6 - 8 баллов) по прогнозу 1-, 2- и 3-летней смертности.
Пояснения: шкала GAP используется для оценки риска летального исхода у больных ИЛФ.
