"МР 3.1.5.0298-22. 3.1.5. Эпидемиология. Профилактика инфекционных болезней. ВИЧ-инфекция. Предупреждение развития заболеваний папилломавирусной этиологии у ВИЧ-инфицированных лиц. Методические рекомендации"
Утверждаю
Руководитель Федеральной службы
по надзору в сфере защиты прав
потребителей и благополучия человека,
Главный государственный
санитарный врач
Российской Федерации
А.Ю.ПОПОВА
10 августа 2022 г.
3.1.5. ЭПИДЕМИОЛОГИЯ. ПРОФИЛАКТИКА ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ.
ВИЧ-ИНФЕКЦИЯ
ПРЕДУПРЕЖДЕНИЕ
РАЗВИТИЯ ЗАБОЛЕВАНИЙ ПАПИЛЛОМАВИРУСНОЙ ЭТИОЛОГИИ
У ВИЧ-ИНФИЦИРОВАННЫХ ЛИЦ
МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ
МР 3.1.5.0298-22 <*>
--------------------------------
<*> МР 3.1.5.0298-22 введены взамен МР 3.1.0155-19 "Предупреждение развития заболеваний папилломавирусной этиологии у ВИЧ-инфицированных женщин", утвержденных Руководителем Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека. Главным государственным санитарным врачом Российской Федерации 29.11.2019.
I. Общие положения и область применения
1.1. Настоящие методические рекомендации (далее - МР) определяют алгоритм выполнения комплекса санитарно-противоэпидемических (профилактических) мероприятий раннего выявления онкологической патологии ВПЧ-ассоциированной этиологии у ВИЧ-инфицированных женщин и мужчин.
1.2. Расширение спектра антиретровирусных препаратов и применение средств комбинированной фармакотерапии привело к увеличению срока жизни ВИЧ-инфицированных пациентов и улучшению ее качества [7]. На фоне значительного снижения частоты ряда оппортунистических инфекций возросла роль заболеваний, вызываемых вирусом папилломы человека (далее - ВПЧ) и способных повлиять на долгосрочное течение ВИЧ-инфекции: рака шейки матки (далее - РШМ), а также рака заднего прохода (ануса), анального канала и полового члена.
МР содержат рекомендации по вакцинации, а также скринингу предраковых заболеваний шейки матки, ануса, анального канала и полового члена для профилактики развития злокачественных новообразований указанной локализации у ВИЧ-инфицированных пациентов.
Развитие предраковых заболеваний и злокачественных новообразований у ВИЧ-инфицированных пациентов (шейка матки и анус - женщины, анус и половой член - мужчины) негативным образом влияют на тяжесть течения и сроки прогрессирования основного заболевания, а также качество жизни.
1.3. МР предназначены для специалистов органов и организаций Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, а также могут быть использованы специалистами медицинских, научно-исследовательских и образовательных организаций медицинского профиля.
II. Заболевания папилломавирусной этиологии
у ВИЧ-инфицированных пациентов
2.1. Вирус папилломы человека (ВПЧ) - антропонозный ДНК-содержащий вирус, относится к роду папилломавирусов (Papillomavirus) семейства папававирусов (Papavaviridae). В настоящее время идентифицировано более 200 типов ВПЧ.
2.1.1. По способности вызывать неопластический процесс выделяют вирус папилломы человека высокого канцерогенного риска (далее - ВПЧ ВКР) и вирус папилломы человека низкого канцерогенного риска (далее - ВПЧ НКР).
2.1.2. ВПЧ ВКР оказывает трансформирующее воздействие на клетки базального слоя эпителия, что может привести к развитию предраковых поражений слизистой оболочки человека. Ежегодно в мире регистрируется более 600 тыс. новых случаев ВПЧ-ассоциированного рака. ВПЧ ВКР является причиной рака шейки матки, рака ануса, рака ротовой полости, гортани и рака полового члена [19].
2.1.2.1. К группе ВПЧ ВКР принадлежат 12 типов <1>: 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58 и 59.
--------------------------------
<1> Согласно классификации Международного Агентства по изучению рака (англ. International Agency for Research on Cancer, IARC), официальный сайт: www.iarc.who.int (в открытом доступе).
Эпидемиологическое значение имеют следующие типы ВПЧ [18, 28, 29]:
- вероятно высокого канцерогенного риска: 68;
- возможно канцерогенные 12 типов: 26, 30, 34, 53, 66, 67, 69, 70, 73, 82, 85, 97.
ВИЧ-положительные женщины и мужчины более чем в 50% случаев - инфицированы сразу несколькими типами ВПЧ ВКР [13, 14, 15].
2.1.3. К группе ВПЧ НКР принадлежат 12 типов: 6, 11, 40, 42, 43, 44, 54, 61, 70, 72, 81 и CP6 108. Данные типы не приводят к развитию онкологических процессов.
2.2. Аногенитальная папилломавирусная инфекция передается преимущественно половым (оральным, генитальным и анальным) путем, а также контактно-бытовым и вертикальным [7, 16, 17].
2.3. Факторами, способствующими хронизации папилломавирусной инфекции (далее - ПВИ), считаются:
- раннее начало половой жизни;
- большое количество половых партнеров;
- аногенитальные контакты (особенно с высокой степенью травматизации);
- иммуносупресспвные состояния;
- воспалительные заболевания цервикального канала, ануса, анального канала и прямой кишки, в том числе, способствующие нарушению целостности эпителия слизистой оболочки.
2.4. Персистирующая ПВИ может привести к развитию предракового состояния: цервикальной интраэпителиальной неоплазии (далее - ЦИН) и анальной интраэпителиальной неоплазии (далее - АИН).
В зависимости от выраженности морфологических изменений выделяют три степени АИН и ЦИН: 1-ю (легкую), 2-ю (умеренную) и 3-ю (тяжелую).
При АИН и ЦИН тяжелой степени поражаются все слои эпителия, что сопровождается высоким риском развития рака ануса и рака шейки матки [30].
2.5. В Российской Федерации рак ануса в статистике учитывается совместно с раком прямой кишки и ректосигмоидного соединения [9].
2.6. У ВИЧ-инфицированных пациентов, в отличие от ВИЧ-негативных, заболеваемость раком шейки матки, раком ануса и раком полового члена регистрируется чаще, независимо от сексуальных предпочтений, и находится в обратной зависимости от уровня CD4'-лимфоцитов [12, 13, 15, 26].
2.7. Прогнозы развития заболеваний папилломавирусной этиологии у ВИЧ-инфицированных пациентов менее благоприятны, чем у лиц в общей популяции. Риски, которые создает ВПЧ ВКР для ВИЧ-положительных лиц, усиливаются рисками, возникающими вследствие ВИЧ-инфекции [12, 13, 15, 20, 25, 26, 27].
III. Профилактика ВПЧ-ассоциированных
злокачественных новообразований
3.1. Система профилактики рака шейки матки, рака ануса и рака полового члена включает первичную и вторичную профилактику.
Первичная профилактика - система мер по выявлению факторов риска развития ВПЧ-ассоциированных злокачественных заболеваний и их устранение: профилактика и выявление факторов риска распространения ПВИ и других инфекций, передаваемых половым путем; использование барьерных методов контрацепции; повышение информированности и пропаганда здорового образа жизни; борьба с курением, употреблением психоактивных веществ и алкоголя; разработка и внедрение профилактических вакцин.
Вторичная профилактика - скрининг, т.е. обследование женщин и мужчин с целью выявления и своевременного лечения предраковых заболеваний для профилактики онкологической патологии шейки матки, ануса и полового члена.
3.2. Применение вакцин для профилактики ВПЧ-ассоциированных заболеваний рекомендуется [24]:
- для рутинной вакцинации девочек и мальчиков до начала половой жизни (в возрасте от 9 лет до 14 лет);
- в возрасте до 26 лет в случае отсутствия вакцинации до начала половой жизни;
- в возрасте от 27 до 45 лет при наличии фактора риска и отсутствии ранее выполненной вакцинации.
3.2.1. Существуют следующие виды вакцин <2> для профилактики ВПЧ-ассоциированных заболеваний:
--------------------------------
<2> Всемирная организация здравоохранения (англ. World Health Organization. WHO, ВОЗ), официальный сайт: www.who.int (в открытом доступе).
- вакцина против вируса папилломы человека квадривалентная рекомбинантная (типов 6, 11, 16, 18) (например, Гардасил или аналогичная);
- вакцина против вируса папилломы человека рекомбинантная, адсорбированная, содержащая адъювант AS04 (например, Церварикс или аналогичная);
- вакцина против вируса папилломы человека 9-валентная рекомбинантная (типов 6, 11, 16, 18, 31, 33, 45, 52, 58) (например, Гардасил 9 или аналогичная).
3.2.2. Для ВИЧ-инфицированных пациентов рекомендуются введение трех доз вакцины с интервалом 0 - 1/2 - 6 месяцев.
3.2.3. Для ВИЧ-инфицированных женщин и мужчин рекомендуется использовать вакцины, действующие против большего количества типов ВПЧ ВКР.
3.2.4. ВИЧ-инфицированным женщинам и мужчинам в возрасте от 27 до 45 лет перед вакцинацией рекомендуется проводить скрининг предраковых заболеваний (шейка матки и анус - женщины, анус и половой член - мужчины) для исключения уже имеющейся патологии.
3.2.5. Наличие ПВИ противопоказанием для проведения вакцинации не является.
3.2.6. Проведенная вакцинация не отменяет участие пациента в скрининге ВПЧ-ассоциированных заболеваний [3, 4, 5, 6].
3.3. Скрининг проводится для выявления и своевременного лечения предраковых поражений шейки матки, ануса и полового члена с целью профилактики развития злокачественных новообразований данных локализаций. В процессе скрининга используются следующие методы или их сочетание: физикальный; цитологическое исследование мазков (традиционная или жидкостная цитология); методы амплификации нуклеиновых кислот (далее - МАНК).
3.3.1. Физикальный осмотр включает визуальную оценку состояния эпителия исследуемого органа, а также пальпацию полового члена и зон регионарного метастазирования (паховые области).
3.3.1.1. Визуальный метод - самый простой и доступный способ оценки состояния эпителия шейки матки (кольпоскопия) или ануса/анального канала/прямой кишки (аноскопия).
3.3.1.2. Преимущества метода: простота, доступность и низкая стоимость. Недостатки метода - зависимость результатов от качества подготовки медицинского персонала, низкая специфичность, получение ложноположительных результатов при пробе с раствором Люголя, неинформативность при II - III типе ЗТ (зона трансформации - область стыка многослойного плоского и цилиндрического эпителия - смещается в цервикальный канал, и ее невозможно визуализировать) [6, 8].
3.3.2. Цитологическое исследование (ПАП-тест, мазок по Папаниколау) эпителиальных клеток шейки матки/цервикального канала, анального канала и слизистых оболочек уретры/крайней плоти/головки полового члена - исследование, которое направлено на выявление онкологической патологии (наличие атипичных клеток, дисплазия различной степени тяжести).
3.3.2.1. Данное исследование может быть проведено традиционным цитологическим методом или методом жидкостной цитологии (предпочтительнее).
3.3.2.2. Недостатки жидкостной цитологии:
- требует специально обученного медицинского персонала, специального оборудования и реактивов.
Преимущества метода:
- полученные препараты имеют более высокое качество и более высокую чувствительность выявления интраэпителиальных поражений;
- меньшее количество "недостаточно адекватных" и неадекватных препаратов;
- на исследование каждого препарата затрачивается меньше времени, что повышает производительность и рентабельность;
- возможность приготовления дополнительного стеклопрепарата из образца;
- полученный материал может быть использован также для исследования на ДНК ВПЧ и клеточные маркеры прогрессии ЦИН (например, ко-экспрессия белков p16 и Ki67).
Выдачу результатов цитологических исследований проводят в соответствии с терминологической системой Бетесда (англ. Terminology Bethesda System).
3.3.3. МАНК позволяют определить нуклеиновую кислоту вируса папилломы человека высокого канцерогенного риска в исследуемом образце (далее - НК ВПЧ ВКР).
3.3.3.1. Преимущества выявления НК ВПЧ ВКР с помощью МАНК (преимущественно полимеразная цепная реакция), т.е. ВПЧ-тестирование:
- однозначно указывает на наличие или отсутствие ПВИ данной локализации;
- количественный формат исследования характеризует активность ПВИ.
Недостатки метода:
- не позволяет установить стадию развития инфекционного процесса.
3.3.3.2. Для выявления ДНК ВПЧ ВКР рекомендуется использовать наборы реагентов, способные выявить не менее 13 типов ВПЧ ВКР (16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 68) [19].
Точность определения принадлежности пациента к группе риска с использованием данных тестов повышает эффективность выявления предраковых заболеваний и онкологической патологии шейки матки, ануса и полового члена.
3.3.4. Типы биологического материала, используемого для цитологического исследования и ВПЧ-тестирования [8]:
- соскоб эпителиальных клеток со слизистой оболочки цервикального канала;
- мазок/соскоб эпителиальных клеток со слизистой оболочки боковых стенок влагалища;
- мазок/соскоб эпителиальных клеток со слизистой оболочки анального канала/прямой кишки;
- мазок/соскоб эпителиальных клеток со слизистых оболочек уретры/крайней плоти/головки полового члена.
3.3.4.1. Отделяемое боковых стенок влагалища, забранное пациентом самостоятельно для последующего исследования в клинико-диагностической лаборатории, значительно расширяет группу обследуемых пациентов. Взятие материала ВИЧ-инфицированной женщиной самостоятельно для последующего ВПЧ-тестирования является преимуществом, так как позволяет охватить скринингом большее количество женщин при том же количестве специалистов.
3.3.4.2. Отделяемое со слизистой оболочки анального канала, забранное пациентом самостоятельно для последующего исследования в клинико-диагностической лаборатории, значительно расширяет группу обследуемых пациентов.
3.4. Всем ВИЧ-инфицированным пациентам показано назначение антиретровирусной терапии для профилактики развития онкологической патологии [11] <3>.
--------------------------------
<3> Пункт 636 СанПиН 3.3686-21 "Санитарно-эпидемиологические требования по профилактике инфекционных болезней", утвержденные постановлением Главного государственного санитарного врача Российской Федерации от 28.01.2021 N 4 (зарегистрировано Минюстом России 15.02.2021, регистрационный N 62500), с изменениями, внесенными постановлениями Главного государственного санитарного врача Российской Федерации от 11.02.2022 N 5 (зарегистрировано Минюстом России 01.03.2022, регистрационный N 67587), от 25.05.2022 N 16 (зарегистрировано Минюстом России 21.06.2022, регистрационный N 68934) (далее - СанПиН 3.3686-21).
3.5. Половых партнеров/партнерш ВИЧ-инфицированных пациентов с диагностированной ПВИ рекомендуется обследовать на ВПЧ-ассоциированные заболевания с целью профилактики развития злокачественных новообразований.
IV. Особенности проведения скрининга предраковых заболеваний
шейки матки у ВИЧ-инфицированных женщин
4.1. Рак шейки матки (РШМ) - заболевание, контролируемое проведением профилактических мероприятий (вакцинация, скрининг предраковых заболеваний шейки матки). Основой профилактики РШМ является своевременно проведенный скрининг.
4.2. Впервые выявленные ВИЧ-инфицированные женщины, вне зависимости от количества CD4+-лимфоцитов, осматриваются врачом акушером-гинекологом: у них необходимо собрать сексуальный и гинекологический анамнез, провести скрининг с целью выявления и своевременного лечения предраковых изменений шейки матки [4 6, 10, 21].
4.3. Схема скрининга ВИЧ-инфицированных женщин:
- начало скрининга - в возрасте 21 года или в течение первого года после начала половой жизни;
- окончание скрининга - продолжается пожизненно (в отличие от общей популяции, где скрининг завершается в 69 лет);
- в возрасте 21 - 29 лет для скрининга используется цитологическое исследование не реже 1 раза в год;
- в возрасте старше 30 лет для скрининга используется цитологическое исследование совместно с ВПЧ-тестированием не реже 1 раза в 3 года.
4.4. Для ВИЧ-инфицированных женщин моложе 30 лет основным способом скрининга предраковых заболеваний шейки матки является ПАП-тест. Алгоритм наблюдения ВИЧ-инфицированных женщин данной возрастной группы представлен на рис. 1:
- если при проведении первоначального ПАП-теста не выявлено цитологических изменений, следующее обследование должно быть проведено в течение последующих 12 месяцев. Если результаты 3-х последовательных ПАП-тестов не выявили изменений, то следующее обследование рекомендуется проводить через 3 года;
- при выявлении изменений в ПАП-тесте и ДНК ВПЧ при выполнении ВПЧ-теста, рекомендуется проведение кольпоскопии и решение вопроса о необходимости проведения биопсии. В данном случае применение ВПЧ-тестирования позволяет сократить время наблюдения;
- при обнаружении ASC-US (англ, atypical squamous cells undertermined significance - атипические клетки плоского эпителия неясного значения, далее - ASC-US), если ВПЧ-тестирование недоступно, рекомендовано проведение цитологического исследования через 6 и 12 месяцев. При выявлении интраэпителиальных поражений рекомендовано повторение цитологического исследования и проведение кольпоскопии с биопсией.
4.5. Для ВИЧ-инфицированных женщин моложе 30 лет рекомендуется проведение ПАП-теста (не реже 1 раза в год), а не ВПЧ-тестирование, ввиду того, что:
- в этой возрастной группе наблюдается наибольшая сексуальная активность (отрицательный результат ВПЧ-теста не гарантирует отсутствие ВПЧ-инфекции при смене полового партнера);
- в этом возрасте у ВИЧ-инфицированных женщин наблюдается высокая скорость прогрессирования интраэпителиальных поражений и возможное развитие интраэпителиальных поражений высокой степени тяжести или РШМ.

Рис. 1. Алгоритм скрининга предраковых заболеваний шейки
матки у ВИЧ-инфицированных женщин моложе 30 лет
4.6. Для ВИЧ-инфицированных женщин старше 30 лет скрининг предраковых заболеваний шейки матки основан на совместном применении ВПЧ-тестировання и цитологического исследования. Алгоритм наблюдения ВИЧ-инфицированных женщин в возрасте старше 30 лет представлен на рис. 2:
- отрицательный результат ВПЧ-теста свидетельствует о минимальном риске развития предраковых и раковых поражений в длительной перспективе, что обеспечивает удлиненный интервал между обследованиями у ВИЧ-инфицированных женщин старше 30 лет и имеющих отрицательные результаты ПАП-теста и ВПЧ-теста;
- при недоступности ВПЧ-тестирования, рекомендуется использовать цитологическое исследование;
- при невозможности использования ВПЧ-тестирования основное значение имеет результат ПАП-теста. Если при первоначальном ПАП-тесте не выявлено цитологических изменений, следующий ПАП-тест должен быть проведен в течение последующих 12 месяцев. Если выявлено отсутствие цитологических изменений по результатам 3-х последовательных ПАП-тестов, то следующее обследование рекомендуется проводить через 3 года;
- при отсутствии цитологических изменений по результатам ПАП-теста и выявлении ДНК ВПЧ (исключая 16 и/или 18 типы), рекомендуется повторение исследования через 12 месяцев;
- при отсутствии цитологических изменений по результатам ПАП-теста и выявлении ДНК ВПЧ (16 и/или 18 типы) рекомендуется проведение кольпоскопии и решение вопроса о необходимости проведения биопсии. В данном случае применение ВПЧ-тестировання позволяет сократить время наблюдения;
- при цитологическом результате ASC-US и обнаруженной ДНК ВПЧ ВКР, рекомендуется повторное цитологическое исследование через 6 и 12 месяцев;
- при выявлении L-SIL (англ. low grade squamous intraepithelial lesion - низкая степень плоскоклеточного интраэпителиального поражения) и H-SIL (англ. hight grade squamous intraepithelial lesion - высокая степень плоскоклеточного интраэпителиального поражения) рекомендовано проведение кольпоскопии с прицельной биопсией.
4.7. При выявлении ИППП, бактериального вагиноза, вульво-вагинального кандидоза и аэробного вагинита скрининг предраковых заболеваний и злокачественных новообразований шейки матки проводится после лечения этих состояний.
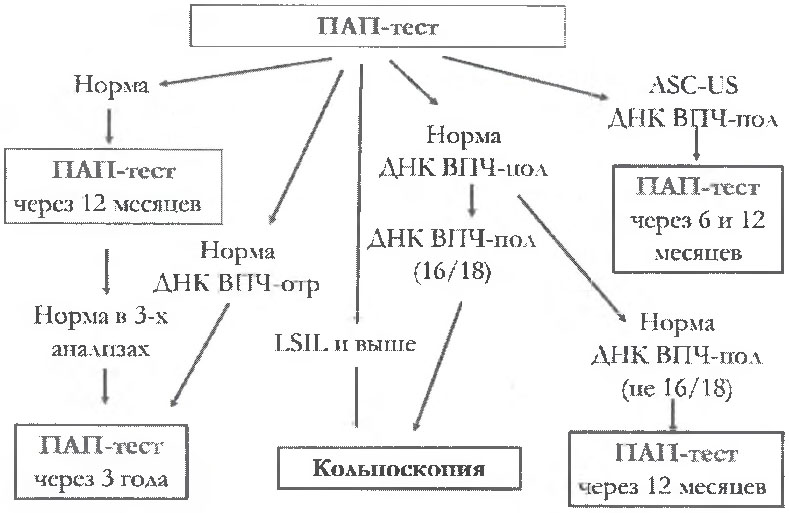
Рис. 2. Алгоритм скрининга предраковых заболеваний шейки
матки у ВИЧ-инфицированных женщин в возрасте старше 30 лет
Данные рекомендации имеют ряд отличий от рекомендаций для общей популяции женщин в Российской Федерации (см. табл.), выполнение которых позволит значительно сократить частоту заболеваемости РШМ у ВИЧ-инфицированных женщин [3, 4].
Таблица
Различия в проведении скрининга предраковых заболеваний
шейки матки у женщин общей популяции и ВИЧ-инфицированных
Показатель
Общая популяция женщин
ВИЧ-инфицированные женщины
Начало скрининга
21 год
21 год или в течение 1-го года после начала половой жизни
Окончание скрининга
69 лет
Продолжается пожизненно
Женщины 21 - 29 лет
ПАП-тест один раз в 3 года
ПАП-тест один раз в год или один раз в 3 года после получения нормы в трех результатах
Женщины в возрасте ![]() 30 лет
30 лет
ВПЧ-ПАП-тест один раз в 5 лет
ВПЧ-ПАП-тест один раз в 3 года
V. Особенности проведения скрининга предраковых заболеваний
ануса и анального канала у ВИЧ-инфицированных пациентов
5.1. Выделены основные группы риска по развитию рака ануса и анального канала среди ВИЧ-инфицированных пациентов:
- женщины с предраковыми заболеваниями шейки матки;
- женщины с выявленным ВПЧ ВКР в соскобе эпителиальных клеток со слизистой оболочки цервикального канала;
- лица, имеющие аногенитальные контакты;
- лица в возрасте ![]() 45 лет;
45 лет;
- длительно получающие стероидные препараты;
- имеющие уровень CD4+-лимфоцитов менее 200 клеток/мкл;
- имеющие жалобы на кровотечения из анального канала, жжение и боль во время дефекации, зуд в области ануса;
- имеющие аногенитальные бородавки (остроконечные кондиломы).
5.2. Ранними проявлениями предраковых заболеваний анального канала/прямой кишки являются кровотечения из прямой кишки, жжение и боль во время дефекации, зуд в области ануса.
5.2.1. Развитие рака ануса и анального канала может протекать бессимптомно, поэтому рекомендуется включить осмотр врача-проктолога в план наблюдения за ВИЧ-инфицированными пациентами для решения вопроса о необходимости проведения скрининга предраковых заболеваний ануса и анального канала.
5.3. Существует два варианта организации скрининга предраковых заболеваний ануса и анального канала (рис. 3):
- первый вариант включает ежегодное цитологическое исследование и ВПЧ-тестирование мазков/соскобов эпителиальных клеток со слизистой оболочки анального канала/прямой кишки;
- второй вариант совмещает скрининг на основе ВПЧ-тестирования с аноскопией, так как некоторые исследователи подчеркивают ограничения использования в скрининге предраковых заболеваний и онкологической патологии ануса цитологического метода (диагностическая чувствительность исследования варьирует в пределах 45 - 70%) [23]. Для всех видимых поражений, выявленных при аноскопин, проводится биопсия с целью определения уровня гистологических изменений и исключения инвазивного рака. Визуальная оценка может также проводиться с использованием пробы с 3 - 5%-й уксусной кислотой либо пробы с раствором Люголя.
Использование второго подхода сокращает время проведения диагностического поиска, что особенно важно при быстром прогрессировании неопластического процесса у ВИЧ-инфицированных пациентов.
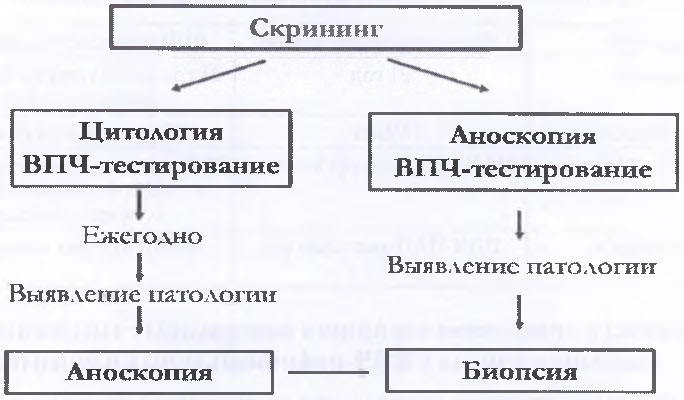
Рис. 3. Алгоритм проведения скрининга предраковых
заболеваний и онкологической патологии ануса и анального
канала у ВИЧ-инфицированных пациентов
5.4. Рак анального канала преимущественно выглядит как инфильтрирующая язва со слегка приподнятыми краями. Изменить визуальную картину при аноскопии могут следующие сопутствующие заболевания:
- геморрой в фазе обострения;
- трещина заднего прохода;
- анальный свищ;
- абсцессы, в том числе развивающиеся в результате инфекций, вызванных C. trachomatis, N. gonorrhoeae;
- язвы, например, вызванные вирусом простого герпеса (Human alphaherpesvirus I и/или H. alphaherpesvirus 2).
5.5. При наличии признаков воспаления рекомендуется взятие биологического материала для выявления N. gonorrhoeae, C. trachomatis, M. genitalium.
5.6. При выявлении во время аноскопии/ректороманоскопии у ВИЧ-инфицированного пациента одного из состояний, указанных в пункте 5.4, и/или выявлении N. gonorrhoeae, C. trachomatis, M. genitalium следует рекомендовать проведение повторной аноскопии/ректороманоскопии после проведенного курса лечения.
5.7. Частоту проведения скрининга предраковых заболеваний анального канала/прямой кишки у ВИЧ-инфицированных пациентов определяет врач-проктолог совместно с врачом-инфекционистом в индивидуальном порядке [22, 23]:
- немедленно при появлении таких жалоб, как кровотечение, тенезмы, боль;
- для женщин с ПВИ и ЦИН каждые 2 - 5 лет, в зависимости от дальнейшей оценки риска;
- ежегодно для лиц в возрасте ![]() 45 лет;
45 лет;
- ежегодно для мужчин в возрасте ![]() 35 лет, имеющих аногенитальные контакты;
35 лет, имеющих аногенитальные контакты;
- ежегодно для лиц с результатами HSIL (англ, high-grade squamous intraepithelial lesions, плоскоклеточное интраэпителиальное поражение высокой степени), полученными при цитологическом исследовании соскоба эпителиальных клеток со слизистой оболочки анального канала прямой кишки.
VI. Особенности проведения скрининга предраковых заболеваний
полового члена у ВИЧ-инфицированных мужчин
6.1. Основные группы риска по раку полового члена среди ВИЧ-инфицнрованных мужчин:
- имеющие аногенитальные контакты;
- имеющие фимоз, расстройства мочеиспускания;
- возраст ![]() 45 лет;
45 лет;
- половые партнерши, которых имеют предраковые заболевания шейки матки или рак шейки матки;
- половые партнеры/партнерши, которых имеют предраковые заболевания ануса или рак ануса;
- имеющие уровень CD4+-лимфоцитов менее 200 клеток/мкл;
- имеющие такие жалобы, как изменение цвета кожи полового члена, его припухлость, увеличение паховых лимфатических узлов;
- имеющие аногенитальные бородавки (остроконечные кондиломы).
6.2. Ранними проявлениями рака полового члена являются изменения кожи (изменение цвета и/или плотности кожи, появление язв или высыпаний), припухлость полового члена, увеличение паховых лимфатических узлов.
6.2.1. Развитие рака полового члена может протекать бессимптомно, поэтому при выявлении у ВИЧ-инфицированного мужчины одного из состояний, указанных в пункте 6.1, рекомендуется включить осмотр врача-уролога в план наблюдения за ВИЧ-инфицированным пациентом для решения вопроса о необходимости проведения скрининга предраковых заболеваний полового члена.
6.3. Для скрининга предраковых заболеваний и онкологической патологии полового члена применяют физикальный осмотр, ультразвуковое исследование, цитологическое исследование, МАНК (ВПЧ-тестирование). В случае подозрения на рак полового члена проводится биопсия.
6.4. При наличии признаков воспаления рекомендуется взятие биологического материала для выявления N. gonorrhoeae, C. trachomatis, M. genitalium.
6.4.1. При выявлении у ВИЧ-инфицированного мужчины одного из заболеваний, вызванных возбудителями, указанными в пункте 6.4, рекомендуется проводить повторный осмотр после проведенного курса лечения.
6.5. Частоту проведения скрининга предраковых заболеваний полового члена определяет в индивидуальном порядке врач-уролог совместно с врачом-инфекционистом.
Библиографические ссылки
1. Федеральный закон от 30.03.1999 N 52-ФЗ "О санитарно-эпидемиологическом благополучии населения".
2. План мероприятий по реализации в 2018 году 1 этапа Национальной стратегии действий в интересах женщин на 2017 - 2022 годы, утвержденный распоряжением Правительства Российской Федерации от 14.03.2018 N 420-р.
3. СанПиН 3.3686-21 "Санитарно-эпидемиологические требования по профилактике инфекционных болезней".
4. Приказ Минздрава России от 13.03.2019 N 124н "Об утверждении порядка проведения профилактического медицинского осмотра и диспансеризации определенных групп взрослого населения".
5. Приказ Минздрава России от 01.11.2012 N 572н "Об утверждении Порядка оказания медицинской помощи по профилю "акушерство и гинекология (за исключением использования вспомогательных репродуктивных технологий)".
6. Письмо Минздрава России от 02.11.2017 N 15-4/10/2-7676 "О направлении клинических рекомендаций (протокола лечения) "Доброкачественные и предраковые заболевания шейки матки с позиции профилактики рака".
7. ВИЧ-инфекция и СПИД: национальное руководство / под ред. В.В. Покровского. 2-е изд., перераб. и доп. Москва: ГЭОТАР-Медиа, 2020. 696 с.: ил. (Серия "Национальные руководства").
8. Домонова Э.А., Творогова М.Г., Подколзин А.Т. и др. Взятие, транспортировка, хранение биологического материала для ПЦР-диагностики: Методические рекомендации / М.: ФБУН ЦНИИ Эпидемиологии Роспотребнадзора, 2021. 112 с. doi: https://doi.org/10.36233/978-5-6045286-6-2, https://www.crie.ni/pdf/clinmat.pdf.
9. Каприн А.Д., Старинский В.В., Шахзадова А.О., ред. Состояние онкологической помощи населению России в 2019 году. М.: МНИОИ им. П.А. Герцена - филиал ФГБУ "НМИЦ радиологии" Минздрава России, 2020. илл. 239 с.
10. Клинические рекомендации "Цервикальная интраэпителиальная неоплазия, эрозия и эктропион шейки матки" утверждены Минздравом России (рубрикатор клинических рекомендаций: https://cr.minzdrav.gov.ni/schema/597_1).
11. Рекомендации по лечению ВИЧ-инфекции и связанных с ней заболеваний, химиопрофилактике заражения ВИЧ / В.В. Покровский, О.Г. Юрин, А.В. Кравченко [и др.] // Эпидемиология и инфекционные болезни. Актуальные вопросы. 2021. Т. 11. N S4. С. 3 - 103. EDN GXCPQR.
12. Попова А.А. Онкогинекологическая патология папилломавирусной этиологии у ВИЧ-инфицированных женщин / Попова А.А., Степанова А.Г., Покровская А.В. // Эпидемиология и инфекционные болезни. Актуальные вопросы. 2015. N 1. С. 53 - 55.
13. Попова А.А., Домонова Э.А., Покровская А.В., Климова Н.А., Шипулина О.Ю., Покровский В.В. Распространенность вируса папилломы человека высокого канцерогенного риска по результатам анального скрининга мужчин, стратифицированных по сексуальному поведению и ВИЧ-статусу. Эпидемиология и инфекционные болезни. Актуальные вопросы. 2020. Т. 10. N 3. С. 33 - 38. https://doi.org/10.18565/epidem.2020.10.3.33-8.
14. Попова А.А. Частота выявления вируса папилломы человека высокого канцерогенного риска у ВИЧ-инфицированных женщин в странах Восточной Европы и Центральной Азии / Попова А.А., Шипулина О.Ю., Алмамедова Э.А., Рзаева А.М., Кадырова А.А., Григорян С.Р., Асмарян А.Э., Пепанян А.А., Давидян А.С., Ермоленко Л.А., Невмержицкая Т.Б., Тавтын И.П., Кадырбеков У.К., Абылгазиева Н.Б., Жаанбаева Ж.Б., Спирин А.В., Агафонова О.В., Чесноков М.Б., Каленик Л.В., Каримов С.С., Рахимова Р.А., Мехриннсо С.Р., Стребкова Е.А., Дмитрюкова М.Ю., Деулина М.О., Покровский В.В. // Журнал инфектологии. 2018. Т. 10. N 3. С. 45 - 48.
15. Шипулина О.Ю. Распространение высокоонкогенных генотипов вируса папилломы человека у ВИЧ-позитивных и ВИЧ-негативных женщин // Шипулина О.Ю., Попова А.А., Кравченко А.В., Деулина М.О., Дмитрюкова М.Ю., Романюк Т.Н. // Инфекционные болезни. 2016; 14(4): 26 - 30.
16. Шипулина О.Ю. Частота выявления вируса папилломы человека и инфекций, передаваемых половым путем, среди студенток медицинского ВУЗа и факторы распространения инфекции / Шипулина О.Ю., Шаргородская А.В., Романюк Т.Н., Роговская С.И., Шипулин Г.А. // Эпидемиология и инфекционные болезни. Актуальные вопросы. 2012. N 3. С. 26 - 31.
17. Шипулина О.Ю. Оценка частоты выявления ИППП и вирусов папилломы человека высокого и низкого онкогенного риска среди девушек-подростков Московской области / Шипулина О.Ю., Михеева И.В., Романюк Т.Н., Куевда Д.А., Краснопольский В.И., Зароченцева Н.В., Белая Ю.М., Мельник Т.Н., Шипулин Г.А. // Эпидемиология и Вакцинопрофилактика. 2011. N 6 (61). С. 35 - 41.
18. Bzhalava D., Eklund C., Dillner J. International standardization and classification of human papillomavirus types // Virology. 2015 Feb; 476: 341 - 344. doi: 10.1016/j.virol.2014.12.028.
19. Cancers Associated with Human Papillomavirus (HPV). Last reviewed: December 13, 2021. https://www.cdc.gov/cancer/hpv/basic_info/cancers.htm
20. Dryden-Peterson S., Bvochora-Nsingo M., Suneja G. et al. HIV Infection and Survival Among Women With Cervical Cancer. J Clin Oncol. 2016 Nov 1; 34(31): 3749 - 3757, doi: 10.1200/JC0.2016.67.9613.
21. Guidelines for the Prevention and Treatment of Opportunistic Infections in HIV-Infected Adults and Adolescents. Last Updated: Aug. 18, 2021, https://www.idsociety.org/practice-guideline/prevention-and-treatment-of-opportunistic-infections-among-adults-and-adolescents
22. Guidelines of American Cancer Society. Last reviewed: 2022. https://www.cancer.org/cancer.
23. Hillman R.J., Berry-Lawhorn J.M., Ong J.J., Cuming T., Nathan M., Goldstone S., Richel O., F Barrosso L., M Darragh T., Law C., Bouchard C., Stier E.A., Palefsky J.M., Jay N. International Anal Neoplasia Society Guidelines for the Practice of Digital Anal Rectal Examination. J Low Genit Tract Dis. 2019 Mar 19. doi: 10.1097/LGT.0000000000000458.
24. HPV Vaccine Recommendations. Vaccines and Preventable Diseases, CDC. Last reviewed: November 16, 2021. https://www.cdc.gov/vaccines/vpdyhpv/hcp/recommendations.html.
25. Kreuter A., Brockmeyer N.H., Hochdorfer B., et al. Clinical spectrum and virologic characteristics of anal intraepithelial neoplasia in HIV infection. J Am Acad Dermatol 2005; 52: 603 - 608.
26. Lin C.C., Hsieh M.C., Hung H.C., Tsao S.M., Chen S.C., Yang H.J., et al. Human papillomavirus prevalence and behavioral risk factors among HIV-infected and HIV-uninfected men who have sex with men in Taiwan. Medicine (Baltimore). 2018; 97(45): e13201. https://doi.org/10.1097/md.0000000000013201.
27. Peterson SD, Nsingo MB, Suneja G, et al. HIV infection and survival among women with cervical cancer. J Clin Oncol 2016; doi: 10.1200/JCO.2016.67.9613.
28. Schiffman M., Clifford G., Buonaguro F.M. Classification of weakly carcinogenic human papilloma virus types: addressing the limits of epidemiology at the borderline. Infect Agent Cancer. 2009 Junl; 4: 8. doi: 10.1186/1750-9378-4-8.
29. Tjalma W.A., Fiander A., Reich O., Powell N., Nowakowski A.M., Kirschner B., et al., Differences in human papillomavirus type distribution in high-grade cervical intraepithelial neoplasia and invasive cervical cancer in Europe Int. J. Cancer. 2013; 132: 854 - 867. doi: 10.1002/ijc.27713.
30. Valvo F., Ciurlia E., Avuzzi B., Doci R., Ducreux M., Roelofsen F., Roth A., Trama A., Wittekind C., Bosset J.F. Cancer of the anal region. Crit Rev Oncol Hematol. 2019 Mar; 135: 115 - 127. doi: 10.1016/j.critrevonc.2018.12.007.
Методические рекомендации разработаны ФБУН "Центральный научно-исследовательский институт эпидемиологии" Роспотребнадзора (А.А. Попова, Э.А. Домонова, Г.В. Лешкина, З.К. Суворова, В. В. Покровский).
