"Клинические рекомендации "Стабильная ишемическая болезнь сердца"
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ
СТАБИЛЬНАЯ ИШЕМИЧЕСКАЯ БОЛЕЗНЬ СЕРДЦА
МКБ 10: I20.0, I20.1, I20.8, I20.9, I25.0, I25.1, I25.2, I25.3, I25.4, I25.5, I25.6, I25.8, I25.9
Год утверждения (частота пересмотра): 2020
ID: КР155/1
URL
Профессиональные ассоциации
- Российское кардиологическое общество При участии: - Национального общества по изучению атеросклероза - Национального общества по атеротромбозу - Ассоциации сердечно-сосудистых хирургов России
Одобрено Научно-практическим Советом Минздрава РФ
Ключевые слова
Список сокращений
АВК - непрямые антикоагулянты (антагонисты витамина K);
АГ - артериальная гипертония;
АД - артериальное давление;
АСК - ацетилсалициловая кислота**;
БАБ - бета-адреноблокаторы;
БКК - блокаторы "медленных" кальциевых каналов;
ВСС - вазоспастическая стенокардия;
ДГП-БКК - дигидропиридиновые блокаторы "медленных" кальциевых каналов;
ЕОК - Европейское общество кардиологов;
иАПФ - ингибиторы ангиотензин-превращающего фермента;
ИБС - ишемическая болезнь сердца;
ИМ - инфаркт миокарда;
ИМТ - индекс массы тела;
КА - коронарная артерия;
КАГ - коронароангиография;
КШ - коронарное шунтирование в условиях искусственного кровообращения или коронарное шунтирование на работающем сердце без использования искусственного кровообращения;
ЛВП - липопротеиды высокой плотности;
ЛЖ - левый желудочек;
ЛКА - левая коронарная артерия;
ЛНП - липопротеиды низкой плотности;
МКБ 10 - Международная классификация болезней X пересмотра;
МРТ - магнитно-резонансная томография;
МСКТА - мультиспиральная компьютерная томографическая ангиография коронарных артерий или компьютерно-томографическая коронарография
не-ДГП-БКК - недигидропиридиновые блокаторы "медленных" кальциевых каналов;
НЛС - нарушение локальной сократимости;
ОКС - острый коронарный синдром;
ОФЭКТ - однофотонная эмиссионная компьютерная томография миокарда перфузионная с функциональными пробами;
ОХС - общий холестерин;
ПНА - передняя нисходящая артерия;
ПОАК - прямые оральные антикоагулянты (в соответствии с АТХ-классификацией антикоагулянты прямые (гепарин и его производные));
ПТВ - предтестовая вероятность;
РКК - резерв коронарного кровотока;
СД - сахарный диабет;
СКФ - скорость клубочковой фильтрации;
СКАВЛС - стент для коронарных артерий, выделяющий лекарственное средство***;
СН - сердечная недостаточность;
ССЗ - сердечно-сосудистые заболевания;
ССО - сердечно-сосудистые осложнения;
ССС - сердечно-сосудистая система;
ТАТ - тройная антитромботическая терапия;
ТГ - триглицериды;
ТФН - толерантность к физической нагрузке;
ТЭО - тромбоэмболические осложнения
УДД - уровень достоверности доказательств;
УУР - уровень убедительности рекомендаций;
ФВ - фракция выброса;
ФК - функциональный класс;
ФР - факторы риска;
ХБП - хроническая болезнь почек;
ХКС - хронический коронарный синдром;
ХсЛНП - холестерин липопротеидов низкой плотности;
ЧКВ - чрескожные коронарные вмешательства (транслюминальная баллонная ангиопластика и стентирование коронарных артерий или стентирование коронарной артерии);
ЧПЭС - чреспищеводная электрокардиостимуляция;
ЧСС - частота сердечных сокращений;
ЭКГ - электрокардиограмма;
ЭхоКГ - эхокардиография;
iFR, МРК - instantaneous wave-free ratio, моментальный резерв кровотока;
FFR, ФРК - фракционный резерв кровотока
Термины и определения
Стент для коронарных артерий металлический непокрытый*** (голометаллический стент) - стент, представляющий собой металлический каркас из биологически инертного материала.
Доказательная медицина - надлежащее, последовательное и осмысленное использование современных наилучших доказательств (результатов клинических исследований) в процессе принятия решений о состоянии здоровья и лечении пациента [1].
Заболевание - возникающее в связи с воздействием патогенных факторов нарушение деятельности организма, работоспособности, способности адаптироваться к изменяющимся условиям внешней и внутренней среды при одновременном изменении защитно-компенсаторных и защитно-приспособительных реакций и механизмов организма [2].
Инструментальная диагностика - диагностика с использованием для обследования пациента различных приборов, аппаратов и инструментов.
Исход - любой возможный результат, возникающий от воздействия причинного фактора, профилактического или терапевтического вмешательства, все установленные изменения состояния здоровья, возникающие как следствие вмешательства [3].
Конфликт интересов - ситуация, при которой у медицинского или фармацевтического работника при осуществлении ими профессиональной деятельности возникает личная заинтересованность в получении лично либо через представителя компании материальной выгоды или иного преимущества, которое влияет или может повлиять на надлежащее исполнение ими профессиональных обязанностей вследствие противоречия между личной заинтересованностью медицинского работника или фармацевтического работника и интересами пациента [2].
Клиническое исследование - любое исследование, проводимое с участием человека в качестве субъекта для выявления или подтверждения клинических и/или фармакологических эффектов исследуемых продуктов и/или выявления нежелательных реакций на исследуемые продукты, и/или изучения их всасывания, распределения, метаболизма и выведения с целью оценить их безопасность и/или эффективность. Термины "клиническое испытание" и "клиническое исследование" являются синонимами [4].
Лабораторная диагностика - совокупность методов, направленных на анализ исследуемого материала с помощью различного специализированного оборудования.
Лекарственные препараты - лекарственные средства в виде лекарственных форм, применяемые для профилактики, диагностики, лечения заболевания, реабилитации, для сохранения, предотвращения или прерывания беременности [5].
Медицинское вмешательство - выполняемые медицинским работником и иным работником, имеющим право на осуществление медицинской деятельности, по отношению к пациенту, затрагивающие физическое или психическое состояние человека и имеющие профилактическую, диагностическую, лечебную, реабилитационную или исследовательскую направленность виды медицинских обследований и (или) медицинских манипуляций, а также искусственное прерывание беременности [2].
Медицинский работник - физическое лицо, которое имеет медицинское или иное образование, работает в медицинской организации и в трудовые (должностные) обязанности которого входит осуществление медицинской деятельности, либо физическое лицо, которое является индивидуальным предпринимателем, непосредственно осуществляющим медицинскую деятельность [2].
Острый инфаркт миокарда (ИМ) - острое повреждение (некроз) миокарда вследствие ишемии, подтвержденное характерной динамикой уровня биомаркеров в крови.
Острый коронарный синдром (ОКС) - термин, обозначающий любую группу клинических признаков или симптомов, позволяющих подозревать острый инфаркт миокарда или нестабильную стенокардию.
Операция коронарного шунтирования - наложение обходного анастомоза, позволяющего улучшить кровоток дистальнее гемодинамически значимого стеноза в коронарной артерии. В зависимости от методики включает аортокоронарное, маммарокоронарное и другие виды шунтирования.
Пациент - физическое лицо, которому оказывается медицинская помощь или которое обратилось за оказанием медицинской помощи независимо от наличия у него заболевания и от его состояния [2].
Рабочая группа по разработке/актуализации клинических рекомендаций - коллектив специалистов, работающих совместно и согласованно в целях разработки/актуализации клинических рекомендаций и несущих общую ответственность за результаты данной работы.
Состояние - изменения организма, возникающие в связи с воздействием патогенных и (или) физиологических факторов и требующие оказания медицинской помощи [2].
Синдром - устойчивая совокупность ряда симптомов с единым патогенезом [6].
Стент для коронарных артерий, выделяющий лекарственное средство*** (СКАВЛС) - стент, из структур которого выделяется антипролиферативное вещество, препятствующее образованию неоинтимы и за счет этого способствующее замедлению повторного стенозирования.
Уровень достоверности доказательств (УДД) - степень уверенности в том, что найденный эффект от применения медицинского вмешательства является истинным [7].
Уровень убедительности рекомендаций (УУР) - степень уверенности в достоверности эффекта вмешательства и в том, что следование рекомендациям принесет больше пользы, чем вреда в конкретной ситуации [7].
Хирургическое лечение - метод лечения заболеваний путем разъединения и соединения тканей в ходе хирургической операции.
Чрескожное коронарное вмешательство - восстановление кровотока в стенозированном участке коронарной артерии с использованием чрескожного введения необходимых для этого устройств. Включает чрескожную баллонную ангиопластику, коронарное стентирование и другие, менее распространенные методики. Как правило, если не указано иное, под чрескожным коронарным вмешательством подразумевают коронарное стентирование.
1. Краткая информация
1.1 Определение заболевания или состояния (группы заболеваний или состояний)
Ишемическая болезнь сердца (ИБС) - поражение миокарда, вызванное нарушением кровотока по коронарным артериям (КА) [8 - 11]. ИБС возникает в результате органических (необратимых) и функциональных (преходящих) изменений. Главная причина органического поражения - атеросклероз КА. К функциональным изменениям относят спазм и внутрисосудистый тромбоз. Понятие "ИБС" включает в себя острые преходящие (нестабильные) и хронические (стабильные) состояния.
Комментарий: В рекомендациях Европейского общества кардиологов 2019 года пересмотра по лечению стабильных форм ИБС [12] введено понятие хронических коронарных синдромов (ХКС) и определены шесть клинических сценариев, наиболее часто встречающихся у пациентов со стабильной ИБС:
1) пациенты с подозрением на ИБС (с симптомами стабильной стенокардии) и/или одышкой;
2) пациенты с впервые возникшей сердечной недостаточностью (СН) или левожелудочковой дисфункцией и подозрением на ИБС;
3) бессимптомные и симптомные пациенты, у которых стабилизация симптомов произошла в сроки менее одного года после ОКС или пациенты с недавней реваскуляризацией;
4) бессимптомные и симптомные пациенты в сроки более одного года после первичной диагностики ИБС или реваскуляризации;
5) пациенты с клиникой стенокардии и подозрением на ее вазоспастический или микрососудистый характер;
6) бессимптомные лица, у которых при скрининге выявлена ИБС.
Все эти сценарии классифицируются как ХКС, но связаны с различными рисками будущих сердечно-сосудистых событий [например, смерть или инфаркт миокарда (ИМ)], и риск этот может измениться с течением времени - возрасти вследствие недостаточного контроля факторов риска, неоптимальных изменений в образе жизни и/или неадекватной медикаментозной терапии, или в результате неудачной реваскуляризации. Риск может уменьшиться при условии применения грамотной вторичной профилактики и успешной реваскуляризации. Таким образом, ХКС являются различными эволюционными фазами ИБС, за исключением тех ситуаций, когда клиническую картину определяет острый тромбоз коронарных артерий, т.е. ОКС.
В настоящих рекомендациях сохранена прежняя терминология, принятая в РФ.
1.2 Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
В большинстве случаев (~95%) основными причинами развития ИБС являются анатомический атеросклеротический и/или функциональный стеноз эпикардиальных сосудов и/или микрососудистая дисфункция [8, 9]. ИБС - заболевание, развитие которого определяется наличием и дальнейшим ростом обструктивной или необструктивной атеросклеротической бляшки. К редким причинам ИБС (< 5% случаев) относятся врожденные аномалии отхождения коронарных артерий (КА), синдромы Марфана, Элерса-Данло с расслоением корня аорты, коронарные васкулиты при системных заболеваниях соединительной ткани, болезнь Кавасаки и синдром Гурлер, инфекционный эндокардит, передозировка сосудосуживающих препаратов и некоторых наркотических средств, диффузное стенозирование КА в пересаженном сердце, сифилитический мезаортит и ряд других состояний [8 - 10]. В данных рекомендациях редкие формы ИБС не рассматриваются.
Существует целый ряд модифицируемых и немодифицируемых факторов риска развития ИБС.
Главные модифицируемые факторы риска ИБС:
- дислипопротеидемия;
- артериальная гипертония;
- сахарный диабет;
- курение;
- низкая физическая активность;
- ожирение;
- стресс, тревога.
Немодифицируемые факторы риска ИБС:
- мужской пол;
- возраст;
- отягощенный семейный анамнез по сердечно-сосудистым заболеваниям (подтвержденный диагноз инфаркта миокарда или ишемического инсульта у родственников первой линии, у женщин - до 65 лет, у мужчин - до 55 лет).
Социальные факторы риска, предрасполагающие к массовому распространению ИБС в развивающихся странах:
- урбанизация;
- индустриализация;
- несбалансированное питание;
- низкий уровень развития экономики страны.
Ишемия миокарда возникает, когда потребность миокарда в кислороде превышает возможности его доставки с кровотоком по КА. Главные механизмы возникновения ишемии: снижение коронарного резерва (способности к увеличению коронарного кровотока при повышении метаболических потребностей миокарда), а также первичное уменьшение коронарного кровотока вследствие атеросклеротического стеноза.
Потребность миокарда в кислороде определяют три основных фактора: напряжение стенок левого желудочка (ЛЖ); частота сердечных сокращений (ЧСС); сократимость миокарда. Чем выше значение каждого из этих показателей, тем выше потребление миокардом кислорода.
Величина коронарного кровотока зависит от трех основных факторов: сопротивления КА; ЧСС; перфузионного давления (разность между диастолическим давлением в аорте и диастолическим давлением в ЛЖ) [8 - 10, 13].
1.3 Эпидемиология заболевания или состояния (группы заболеваний или состояний)
В России, как и во всем мире, несмотря на проводимые лечебно-профилактические мероприятия, сердечно-сосудистая патология по-прежнему занимает первое место в структуре заболеваемости и смертности. По данным Росстата, с 2010 года наблюдается планомерное снижение смертности от сердечно-сосудистых причин, и в 2017-м она составила 862895 человек или 587,6 на 100000 населения против 1151917 человек или 806,4 на 100000 населения в 2010 году. Тем не менее сердечно-сосудистые заболевания (ССЗ) по-прежнему остаются главной причиной смерти россиян - почти половина (47%) всех случаев смерти. Лидирующую позицию в структуре причин смерти от ССЗ занимает ишемическая болезнь сердца. Ежегодная смертность от ИБС среди населения России - 27%. Немаловажно, что 42% от всех умерших в результате ИБС умирают в трудоспособном возрасте. Больные с установленным диагнозом стабильной стенокардии умирают от ИБС в 2 раза чаще, чем лица без этого заболевания [10]. При этом только 40 - 50% всех больных ИБС знают о наличии у них болезни и получают соответствующее лечение, тогда как в 50 - 60% случаев заболевание остается нераспознанным. Почти у половины больных с ИБС инфаркт миокарда (ИМ) является первым проявлением (манифестацией) заболевания [9, 10]. Это обусловлено тем, что с одной стороны, выявление ИБС представляет собой ряд отработанных диагностических мероприятий, алгоритм которых достаточно хорошо известен, с другой - затруднено при атипичной клинике стенокардии, безболевой ишемии миокарда, редких формах ИБС, ИБС у старшей возрастной группы с различными сопутствующими заболеваниями и прочее.
Распространенность стенокардии как самой часто встречающейся формы ИБС в популяции увеличивается с возрастом у лиц обоего пола: с 5 - 7% среди женщин в возрасте 45 - 64 лет до 10 - 12% среди женщин в возрасте 65 - 85 лет, и с 4 - 7% среди мужчин в возрасте 45 - 64 лет до 12 - 14% среди мужчин в возрасте 45 - 64 лет.
По данным различных регистров, среди всех больных с ИБС ежегодная общая смертность составляет 1,2 - 2,4%, от фатальных сердечно-сосудистых осложнений (ССО) ежегодно погибают 0,6 - 1,4% больных, нефатальные ИМ случаются с частотой 0,6 - 2,7% в год [9 - 11, 13]. Однако в субпопуляциях с различными дополнительными факторами риска (ФР) эти значения могут существенно различаться.
1.4 Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статистической классификации болезней и проблем, связанных со здоровьем
Стенокардия [грудная жаба] (I20) [14]:
I20.1 - Стенокардия с документально подтвержденным спазмом;
I20.8 - Другие формы стенокардии;
I20.9 - Стенокардия неуточненная.
Хроническая ишемическая болезнь сердца (I25):
I25.0 - Атеросклеротическая сердечно-сосудистая болезнь, так описанная;
I25.1 - Атеросклеротическая болезнь сердца;
I25.2 - Перенесенный в прошлом инфаркт миокарда;
I25.3 - Аневризма сердца;
I25.4 - Аневризма коронарной артерии;
I25.5 - Ишемическая кардиомиопатия;
I25.6 - Бессимптомная ишемия миокарда;
I25.8 - Другие формы хронической ишемической болезни сердца;
I25.9 - Хроническая ишемическая болезнь сердца неуточненная.
1.5 Классификация заболевания или состояния (группы заболеваний или состояний)
На практике удобнее пользоваться клинической классификацией стабильной ИБС:
1. Стенокардия:
1.1. Стенокардия напряжения стабильная (с указанием функционального класса по канадской классификации (см. таблицу ПБ1-1, Приложение Б1)).
1.2. Стенокардия вазоспастическая.
1.3. Стенокардия микрососудистая.
2. Кардиосклероз постинфарктный очаговый (с указанием даты перенесенного инфаркта, локализации, типа (в соответствии с универсальным определением ИМ, подготовленным объединенной рабочей группой Европейского общества кардиологов, Американского кардиологического колледжа, Американской ассоциации сердца и Всемирной кардиологической федерации [15]).
3. Безболевая ишемия миокарда [16].
4. Ишемическая кардиомиопатия.
Комментарии по особенностям статистического кодирования ИБС:
В связи с тем, что для микрососудистой и стабильной стенокардии в МКБ-10 не выделено собственных кодов, они объединены в код I20.8.
В разработке статистики смертности коды I20 не используются, т.е. ни одна форма стенокардии не может рассматриваться как первоначальная причина смерти и не может быть зарегистрирована в рубрике "основное заболевание" посмертного клинического и патолого-анатомического диагнозов.
Рубрика I25.0 - Атеросклеротическая сердечно-сосудистая болезнь, так описанная: код соответствует неточно сформулированному диагнозу, применять на практике не следует.
Рубрика I25.1 - Атеросклеротическая болезнь сердца: атеросклероз коронарной(-ых) артерии(-ий) (как причина оказания мед. помощи, связанной с плановым вмешательством на коронарных артериях), должен быть инструментально подтвержден);
нарушения ритма сердца как нозологическая форма из группы ИБС (при обязательном подтверждении атеросклероза коронарных артерий; выносятся как основное заболевание, если нет других нозологий из группы ИБС. В случае наличия других нозологий из группы ИБС, например, постинфарктный кардиосклероз, нарушения ритма сердца целесообразно рассматривать как их осложнение).
Рубрика I25.2 - перенесенный в прошлом ИМ (следует отличать от постинфарктного кардиосклероза - I25.8), предусмотрена ВОЗ только для случаев ИМ, выявленного случайно, ретроспективно и не имеющего на момент выявления и наблюдения пациента никаких клинических проявлений. Привести к летальному исходу эта клиническая ситуация не может и, более того, МКБ-10 накладывает прямой запрет на использование рубрики I25.2 в разработке статистики смертности.
Рубрика I25.3 - Аневризма сердца: хроническая аневризма сердца является не самостоятельной нозологической формой ИБС, а проявлением постинфарктного кардиосклероза, поэтому формулировку клинического диагноза следует начать с термина "постинфарктный кардиосклероз", но саму хроническую аневризму сердца указать в диагнозе следует, так как ее наличие определяет выбор корректного шифра.
Рубрика I25.4 - Аневризма коронарной артерии: если указанные в этой рубрике патологические состояния являются осложнением медицинских процедур, они не могут рассматриваться как основное заболевание/первоначальная причина смерти, а выносятся как осложнение проведенного вмешательства. Если они не связаны с оказанием медицинской помощи, то ограничений для их регистрации как основного заболевания (в т.ч. в случае летального исхода - первоначальной причины смерти) нет.
Рубрика I25.5 - Ишемическая кардиомиопатия сохранена в МКБ-10 (версия 2016 г.). Более того, в проекте МКБ-11 также эта рубрика присутствует. Также МКБ-10 не накладывает никаких ограничений на использование ишемической КМП в статистике смертности.
Рубрика I25.6 - Бессимптомная ишемия миокарда не может рассматриваться в качестве первоначальной причины смерти (основного заболевания в посмертном клиническом и патолого-анатомическом диагнозах). В случае летального исхода выбор первоначальной причины смерти определяется клинической картиной, предшествующей смерти.
Рубрика I25.8 - Другие формы хронической ИБС: в отличие от перенесенного ИМ I25.2 (см. Рубрика I25.2) МКБ-10 определяет постинфарктный кардиосклероз для шифрования (I25.8) как причину смертельного исхода;
атеросклероз коронарного шунта, КА трансплантированного сердца и стентированных ранее КА в случае, если данные патологические состояния явились поводом для плановой высокотехнологичной медицинской помощи. Данные состояния целесообразно рассматривать как первоначальную причину смерти (основное заболевание - в посмертном клиническом/патолого-анатомическом диагнозе), если инвазивное/хирургическое вмешательство по поводу данной патологии привело к развитию летальных осложнений.
Рубрики I20.9 - Стенокардия неуточненная и I25.9 - Хроническая ишемическая болезнь сердца неуточненная: коды соответствует неточно сформулированному диагнозу, применять на практике не следует.
1.6 Клиническая картина заболевания или состояния (группы заболеваний или состояний)
Стабильная ИБС может иметь сравнительно доброкачественное течение на протяжении многих лет. Выделяют стабильную симптомную или бессимптомную фазы, которые могут прерываться развитием острого коронарного синдрома (ОКС).
Постепенное прогрессирование атеросклероза коронарных артерий и сердечной недостаточности (СН) приводит к снижению функциональной активности больных, а иногда - к острым сердечно-сосудистым осложнениям, в том числе фатальным [8, 9, 13].
2. Диагностика
Диагноз ишемической болезни сердца устанавливается на основании совокупности жалоб (клиника стенокардии), данных анамнеза (факторы сердечно-сосудистого риска), выявления с помощью диагностических методов обследования скрытой коронарной недостаточности (ишемии). После установления диагноза для выявления стенозирующего коронарного атеросклероза и определения показаний к хирургическому лечению необходимо проведение коронарографии. При опросе пациента о жалобах (клиника стенокардии) и других клинических проявлениях ИБС врачом могут быть использован опросник Роуза (Приложение Г) для выставления предварительного диагноза ИБС.
2.1 Жалобы и анамнез
На этапе диагностики проводится анализ жалоб и сбор анамнеза у всех пациентов с подозрением на ИБС. Самой частой жалобой при стенокардии напряжения, как наиболее распространенной форме стабильной ИБС, является боль в груди.
С целью выявления клиники стенокардии медицинский работник (врач) расспрашивает пациента с подозрением на ИБС о существовании болевого синдрома в грудной клетке, характере, частоте возникновения и обстоятельствах возникновения и исчезновения.
Признаки типичной (несомненной) стенокардии напряжения:
1) боль (или дискомфорт) в области грудины, возможно, с иррадиацией в левую руку, спину или нижнюю челюсть, реже - в эпигастральную область, длительностью от 2 до 5 (менее 20) мин. Эквивалентами боли бывают: одышка, ощущение "тяжести", "жжения";
2) вышеописанная боль возникает во время физической нагрузки или выраженного психоэмоционального стресса;
3) вышеописанная боль быстро исчезает после прекращения физической нагрузки или через 1 - 3 минуты после приема нитроглицерина.
Для подтверждения диагноза типичной (несомненной) стенокардии необходимо наличие у пациента всех трех вышеперечисленных признаков одновременно. Эквивалентом физической нагрузки может быть кризовое повышение артериального давления (АД) с увеличением нагрузки на миокард, а также обильный прием пищи.
Диагноз атипичной стенокардии ставится, если у пациента присутствуют любые два из трех вышеперечисленных признаков типичной стенокардии.
Признаки неангинозных (нестенокардитических) болей в грудной клетке:
1) боли локализуются попеременно справа и слева от грудины;
2) боли носят локальный, "точечный" характер;
3) боли продолжаются более 30 минут после возникновения (до нескольких часов или суток), могут быть постоянными, "простреливающими" или "внезапно прокалывающими";
4) боли не связаны с ходьбой или иной физической нагрузкой, однако зависят от положения тела: возникают при наклонах и поворотах корпуса, в положении лежа (за исключением стенокардии "decubitus" - истинной стенокардии, возникающей в лежачем положении в результате увеличения венозного возврата и увеличения преднагрузки на сердце с увеличением потребности миокарда в кислороде), при длительном нахождении тела в неудобном положении, при глубоком дыхании на высоте вдоха;
5) боли не купируются приемом нитроглицерина;
6) боли усиливаются при пальпации грудины и/или грудной клетки по ходу межреберных промежутков.
Особенностью болевого синдрома в грудной клетке при вазоспастической стенокардии является то, что болевой приступ, как правило, очень сильный, локализуется в "типичном" месте - в области грудины. Нередко такие приступы случаются ночью и рано утром, а также при воздействии холода на открытые участки тела.
Особенностью болевого синдрома в грудной клетке при микрососудистой стенокардии является то, что ангинозная боль, по качественным признакам и локализации соответствует стенокардии, но возникает через некоторое время после физической нагрузки, а также при эмоциональном напряжении, может возникать в покое и плохо купируется органическими нитратами. Наличие болевого синдрома в грудной клетке должно, прежде всего, настораживать в отношении приступов стенокардии, затем следует искать другие заболевания, которые могут давать сходную симптоматику. Необходимо учитывать, что боль любого генеза (невралгии, гастралгии, боли при холецистите и др.) может провоцировать и усиливать имеющуюся стенокардию.
При выявлении во время расспроса синдрома стенокардии напряжения для оценки его выраженности рекомендуется определить функциональный класс (в соответствии с канадской классификацией стенокардии), в зависимости от переносимой физической нагрузки [13]. (Сбор анамнеза и жалоб при патологии сердца и перикарда)
Различают 4 функциональных класса (ФК) стенокардии по классификации Канадского кардиологического общества [13] (см. таблицу ПБ1-1, Приложение Б1).
У всех пациентов с подозрением на ИБС:
Во время сбора анамнеза с целью выявления факторов риска у пациента с подозрением на ИБС уточняется о курении в настоящее время или в прошлом.
Во время сбора анамнеза с целью выявления факторов риска у пациента с подозрением на ИБС уточняется о случаях ССЗ у ближайших родственников пациента (отец, мать, родные братья и сестры).
Во время сбора анамнеза с целью выявления факторов риска у пациента с подозрением на ИБС уточняется о случаях смерти от ССЗ ближайших родственников (отец, мать, родные братья и сестры).
Во время сбора анамнеза у пациента с подозрением на ИБС уточняется о предыдущих случаях обращения за медицинской помощью и о результатах таких обращений.
Во время сбора анамнеза у пациента с подозрением на ИБС уточняется наличие ранее зарегистрированных электрокардиограмм, результатов других инструментальных исследований и заключений по этим исследованиям с целью оценки изменений различных показателей в динамике.
Во время сбора анамнеза у пациента с подозрением на ИБС уточняется об известных ему сопутствующих заболеваниях с целью оценки дополнительных рисков.
Во время сбора анамнеза у пациента с подозрением на ИБС уточняется обо всех принимаемых в настоящее время лекарственных препаратах с целью коррекции терапии.
Во время сбора анамнеза у пациента с подозрением на ИБС уточняется обо всех препаратах, прием которых ранее был прекращен из-за непереносимости или неэффективности для снижения риска аллергических и анафилактических реакций, а также оптимального выбора медикаментозных препаратов.
2.2 Физикальное обследование
На этапе диагностики всем пациентам с ИБС или подозрением на нее с целью выявления ряда факторов риска, а также сопутствующих заболеваний проводится физикальное обследование.
Во время физикального обследования всем пациентам с ИБС или подозрением на нее проводится общий осмотр, исследование кожных покровов лица, туловища и конечностей пациента с целью выявления патогномоничных признаков различных заболеваний.
Обычно физикальное обследование при неосложненной стабильной ИБС имеет малую специфичность. Иногда при физикальном обследовании можно выявить некоторые факторы риска: избыточную массу тела, сахарный диабет (СД) (расчесы, сухость и дряблость кожи, снижение кожной чувствительности). Очень важны признаки атеросклероза клапанов сердца, аорты, магистральных и периферических артерий: шум над проекциями сердца, брюшной аорты, сонных, почечных и бедренных артерий, наличие клиники перемежающейся хромоты, похолодание стоп, ослабление пульсации артерий и атрофия мышц нижних конечностей. Существенный фактор риска ИБС, выявляемый при физикальном обследовании, - повышение артериального давления. Кроме того, следует обращать внимание на внешние симптомы анемии. У больных с семейными формами гиперхолестеринемии при осмотре можно выявить ксантомы на кистях, локтях, ягодицах, коленях и сухожилиях, а также ксантелазмы на веках. Физикальное обследование может оказаться более информативным, если присутствуют симптомы осложнений ИБС, в первую очередь - СН: одышка, застойные хрипы в легких, кардиомегалия, аритмия, набухание шейных вен, гепатомегалия, отеки ног и прочие. Выявление симптомов СН при физикальном обследовании больного с ИБС обычно заставляет предполагать постинфарктный кардиосклероз и очень высокий риск осложнений, следовательно, диктует необходимость в безотлагательном комплексном лечении, в том числе, возможно, хирургическом.
Во время физикального обследования всем пациентам с ИБС или подозрением на нее измеряют окружность талии (см), рост (м) и вес (кг), определяют индекс массы тела пациента для оценки рисков и прогноза.
Индекс массы тела (ИМТ) рассчитывается по формуле Кеттле: "вес (кг)/рост (м)2". Нормальный ИМТ - от 18,5 до 24,9 кг/м2.
Во время физикального обследования всем пациентам с ИБС или подозрением на нее проводятся: перкуссия и аускультация сердца и легких, пальпация пульса на лучевых артериях и артериях тыльной поверхности стоп, измерение АД по Короткову в положении пациента лежа, сидя и стоя, подсчет ЧСС и частоты пульса, аускультация точек проекций сонных артерий, брюшной аорты, подвздошных артерий, пальпация живота, парастернальных точек и межреберных промежутков с целью выявления ряда признаков, как основного, так и сопутствующих заболеваний.
Оценка предтестовой вероятности ИБС
- Оценка предтестовой вероятности (ПТВ) рекомендована всем пациентам с подозрением на ИБС при первичном обращении к врачу для определения вероятности наличия ИБС [17]. ЕОК I B (УУР C, УДД 5).
Комментарий: После оценки симптомов на первом визите врач определяет расчетную ПТВ ИБС (таблица ПБ1-2, Приложение Б1). ПТВ - это простой показатель вероятности наличия ИБС у пациента, который базируется на оценке характера боли в грудной клетке, возраста и пола [17]. Модель расчета ПТВ была получена в крупных популяционных исследованиях. В предшествующей версии рекомендаций ПТВ ИБС основывалась на данных T.S. Genders и соавт. [18]. Однако в ряде крупных исследований последних лет было показано [19, 20], что такой подход приводит к существенному завышению риска ИБС и сопровождается назначением необоснованных дополнительных специфических диагностических исследований более чем у 50% пациентов [19, 20]. Поэтому таблица ПТВ была модифицирована.
ПТВ ИБС считается очень низкой при значении < 5% (ежегодный риск сердечно-сосудистой смерти или острого инфаркта миокарда < 1% в год). В этом случае диагноз ИБС может быть исключен после первичного обследования, не обнаруживавшего факторов, повышающих ПТВ. ПТВ ИБС > 15% является умеренной и требует проведения не только первичного обследования, но и дополнительных специфических методов диагностики ИБС. ПТВ ИБС 5 - 15% в целом обеспечивает хороший прогноз (ежегодный риск сердечно-сосудистой смерти или острого инфаркта миокарда < 1% в год), но при наличии дополнительных клинических факторов, повышающих вероятность ИБС, или явных симптомов, после проведения первичного обследования может потребовать выполнения дополнительного специфического обследования.
Первичное обследование не является специфичным при диагностике стабильной ИБС, но позволяет выявить факторы, повышающие предтестовую вероятность ИБС, и в ряде случаев обнаружить достаточно характерные для ИБС признаки, например, рубцовые изменения на ЭКГ или нарушения локальной сократимости при ЭхоКГ.
2.3 Лабораторные диагностические исследования
Лишь немногие лабораторные исследования обладают самостоятельной прогностической ценностью при стабильной ИБС. Самым важным параметром является липидный спектр крови. Остальные лабораторные исследования крови и мочи позволяют выявить сопутствующие заболевания и синдромы (сердечную недостаточность, сахарный диабет (СД), дисфункцию щитовидной железы, анемию, эритремию, тромбоцитоз, тромбоцитопению, хроническую печеночную или почечную недостаточность и т.д.), которые ухудшают прогноз ИБС и требуют учета при подборе лекарственной терапии и при возможном направлении больного на оперативное лечение.
- Всем пациентам с ИБС или подозрением на нее при первичном обращении рекомендуется проводить общий (клинический) анализ крови, развернутый с измерением уровня гемоглобина, числа эритроцитов и лейкоцитов для исключения возможных сопутствующих заболеваний, а также вторичного характера возникновения стенокардии [8 - 12]. ЕОК I B (УУР C, УДД 5).
- Всем пациентам с ИБС или подозрением на нее при наличии клинических оснований скрининг для выявления СД рекомендуется начинать с исследования уровня гликированного гемоглобина в крови, исследование уровня глюкозы в крови натощак. Если результаты неубедительны - дополнительно рекомендуется провести пероральный тест толерантности к глюкозе [8 - 12]. ЕОК I B (УУР C, УДД 5).
- Всем пациентам с ИБС или подозрением на нее для определения возможности назначения некоторых лекарственных средств, а также коррекции их доз рекомендуется провести исследование уровня креатинина в крови и оценить состояние функции почек по расчетной скорости клубочковой фильтрации (СКФ) или клиренсу креатинина (КК) (таблица ПБ1-3, Приложение Б1) [21]. ЕОК I B (УУР C, УДД 5).
- Всем пациентам с ИБС или подозрением на нее рекомендуется провести анализ крови для оценки нарушений липидного обмена, биохимический, включая исследование уровня общего холестерина крови, уровня холестерина липопротеидов низкой плотности (ХсЛНП) и триглицеридов (ТГ) [22], с целью выявления фактора риска и, при необходимости, коррекции терапии. ЕОК I C (УУР C, УДД 1).
Комментарий: Дислипопротеидемия - нарушение соотношения основных классов липидов в плазме - ведущий ФР атеросклероза. Проатерогенными считаются липопротеиды низкой плотности и очень низкой плотности, тогда как липопротеиды высокой плотности являются антиатерогенным фактором. При очень высоком содержании ХсЛНП в крови ИБС развивается даже у молодых людей. Низкий уровень холестерина липопротеидов высокой плотности - неблагоприятный прогностический фактор. Высокий уровень ТГ считают значимым предиктором ССО [23 - 25].
- При наличии клинических проявлений патологии щитовидной железы, пациентам с ИБС рекомендуется проводить оценку функции щитовидной железы (исследование уровня тиреотропного гормона (ТТГ) в крови, исследование уровня общего тироксина (Т4) сыворотки крови, исследование уровня свободного тироксина (СТ4) сыворотки крови, исследование уровня свободного трийодтиронина (СТ3) в крови, исследование уровня общего трийодтиронина (Т3) в крови) для выявления заболеваний щитовидной железы, поскольку они могут влиять на состояние ССС. [21] ЕОК I C (УУР C, УДД 5).
- У пациентов с ИБС и подозрением на сердечную недостаточность рекомендуется исследование уровня N-терминального фрагмента натрийуретического пропептида мозгового (NT-proBNP) в крови для исключения наличия сердечной недостаточности и оценки прогноза [21]. ЕОК IIa C (УУР C, УДД 5).
- При клинической нестабильности состояния или при подозрении на ОКС для исключения некроза миокарда пациентам с ИБС рекомендуется повторное исследование уровня тропонинов I, T в крови высоко- или сверхвысокочувствительным методом [21]. ЕОК I A (УУР C, УДД 5).
- У пациентов, жалующихся на симптомы миопатии (мышечные боли) на фоне приема статинов, рекомендуется определение активности креатинкиназы в крови для исключения негативных побочных эффектов статинов и, при необходимости, коррекции терапии [24]. ЕОК I C (УУР C, УДД 5).
- При повторных исследованиях у всех пациентов с диагнозом стабильной ИБС рекомендуется проводить ежегодный контроль общего (клинического) анализа крови развернутого, анализа крови биохимического общетерапевтического, анализа крови по оценке нарушений липидного обмена биохимического, исследование уровня креатинина в крови и исследование уровня глюкозы в крови натощак с целью своевременной коррекции терапии при необходимости [21]. ЕОК I C (УУР C, УДД 5).
- Рекомендуется определение КК по формуле Кокрофта-Голта на основании исследования уровня креатинина в крови у всех пациентов с ИБС и фибрилляцией предсердий с учетом необходимости назначения антикоагулянтов [21]. ЕОК I C (УУР C, УДД 5).
2.4 Инструментальные диагностические исследования
2.4.1 Неинвазивные методы исследования при стабильной ИБС
Электрокардиографическое исследование
- Регистрация 12-канальной электрокардиограммы (ЭКГ) в покое и расшифровка, описание и интерпретация электрокардиографических данных рекомендована всем пациентам с подозрением на ИБС для выявления признаков ишемии в покое (в том числе, безболевой ишемии миокарда), а также возможного наличия зубца Q, сопутствующих нарушений ритма и проводимости сердца [21, 26, 27]. ЕОК I C (УУР C, УДД 4).
Комментарий. При неосложненной стабильной ИБС специфические ЭКГ-признаки ишемии миокарда вне нагрузки обычно отсутствуют. Единственным достаточно специфичным признаком ИБС на ЭКГ покоя является зубец Q после перенесенного острого инфаркта миокарда (ОИМ). Изолированные изменения зубца T малоспецифичные и требуют сопоставления с клиникой заболевания и данными других исследований.
- Регистрация 12-канальной ЭКГ во время или сразу после приступа боли в грудной клетке с расшифровкой, описанием и интерпретацией электрокардиографических данных для выявления признаков ишемии рекомендована всем пациентам с подозрением на ИБС [21, 26]. ЕОК I C (УУР C, УДД 5).
Комментарий. Регистрация ЭКГ во время болевого приступа в грудной клетке имеет большее значение, чем ЭКГ покоя. Если во время боли изменения на ЭКГ отсутствуют, вероятность ИБС у таких больных снижается, хотя заболевание не исключается полностью. Появление изменений ЭКГ во время болевого приступа или сразу после него существенно повышает вероятность ИБС. Специфическими признаками ишемии является горизонтальная или косонисходящая депрессия сегмента ST глубиной не менее 0,1 мВ продолжительностью не менее 0,06 - 0,08 с от точки J в одном и более ЭКГ-отведении. Специфическими признаками вазоспазма служит транзиторный подъем сегмента ST не менее 0,1 мВ в двух и более отведениях. Ишемические изменения ЭКГ сразу в нескольких отведениях являются неблагоприятным прогностическим признаком. Чувствительность метода снижается у больных с исходно измененной ЭКГ вследствие рубцовых изменений, внутрижелудочковых блокад, гипертрофии левого желудочка (ГЛЖ). Изменения сегмента ST не должны расцениваться как признак ишемии у пациентов с пароксизмом суправентрикулярной тахикардии.
Эхокардиографическое исследование
- Трансторакальная эхокардиография (ЭхоКГ) в состоянии покоя с использованием допплеровских режимов рекомендована всем пациентам с подозрением на ИБС для: 1) исключения других причин боли в грудной клетке; 2) выявления нарушений локальной сократимости (НЛС) левого желудочка; 3) измерения фракции выброса (ФВ) ЛЖ; 4) оценки диастолической функции ЛЖ; 5) выявления патологии клапанного аппарата сердца [21, 28 - 30]. ЕОК I B (УУР C, УДД 4).
Комментарий. Эхокардиографическое исследование в покое предоставляет важную информацию об анатомии и функции сердца. Основная цель ЭхоКГ в покое - это оценка систолической и диастолической функции ЛЖ, обнаружение НЛС, а также исключение других причин боли в грудной клетке, в частности, клапанного поражения, перикардита, миокардита, аневризмы восходящей аорты, гипертрофической кардиомиопатии и других заболеваний [17, 28]. Важно помнить, что обнаружение других заболеваний не обязательно исключает ИБС. У пациентов с подозрением на ИБС ФВ ЛЖ часто нормальная. Нарушения локальной сократимости стенок ЛЖ, выявленные при визуальной оценке [18, 29] или с помощью технологий оценки деформации [19, 30], повышают вероятность обнаружения ИБС у пациентов с нормальной функцией ЛЖ. Сниженная ФВ ЛЖ также повышает вероятность обнаружения ИБС. Типичными ЭхоКГ-признаками перенесенного ОИМ являются НЛС на территории кровоснабжения соответствующей артерии. Ранним признаком ИБС или микрососудистой дисфункции может быть нарушенная диастолическая функция ЛЖ [26 - 28].
- Применение контрастных веществ при ЭхоКГ для улучшения визуализации границы эндокарда рекомендуется пациентам с подозрением на ИБС и "плохим" акустическим окном, отсутствием адекватной визуализации двух и более сегментов ЛЖ, у которых нет противопоказаний к введению контрастных веществ [29, 31 - 32]. ЕОК I C (УУР B, УДД 2).
Комментарий. Использование контрастных веществ актуально у пациентов с "плохим" акустическим окном, когда >= 2 сегментов ЛЖ не могут быть визуализированы в покое. Доказан факт улучшения диагностических возможностей ЭхоКГ при оценке нарушений глобальной и локальной сократимости [29, 32].
Магнитно-резонансное томографическое (МРТ) исследование сердца
- Проведение магнитно-резонансной томографии сердца и магистральных сосудов, магнитно-резонансной томографии сердца с контрастированием в состоянии покоя с целью получения информации о структуре и функции сердца рекомендуется пациентам с подозрением на ИБС в случае неубедительных результатов ЭхоКГ и при отсутствии противопоказаний [30, 33]. ЕОК IIa C (УУР C, УДД 2).
Комментарий. МРТ, подобно ЭхоКГ, предоставляет важную информацию о структуре и функции сердца и способна ответить на те вопросы, которые ставят перед ЭхоКГ. МРТ может быть проведена пациентам, у которых отсутствует акустическое окно для проведения ЭхоКГ. В сравнении с ЭхоКГ, МРТ с контрастированием предоставляет дополнительную важную информацию по дифференциальной диагностике некоронарогенных заболеваний (кардиопатий, миокардитов, ряда других) [33].
Ультразвуковое исследование сонных артерий
- Всем пациентам с подозрением на ИБС без ранее верифицированного атеросклероза любой локализации рекомендуется дуплексное сканирование экстракраниальных отделов сонных артерий для выявления атеросклеротических бляшек [34, 35, 36]. ЕОК IIa C (УУР C, УДД 2).
Комментарий. Критерием атеросклеротической бляшки является локальное утолщение комплекса интима-медия (ИМ) >= 1,5 мм или толщина комплекса ИМ, на 50% или 0,5 мм превышающая толщину комплекса ИМ рядом расположенных участков сонной артерии [34, 35]. Наличие признаков атеросклероза сонных артерий у пациентов с подозрением на ИБС сопряжено с повышенным риском ССО и является основанием для назначения статинов.
Рентгенография грудной клетки
- Прицельная рентгенография органов грудной клетки рекомендуется пациентам с нетипичными для ИБС симптомами для исключения иных заболеваний сердца и крупных сосудов, а также внесердечной патологии (патологии других органов средостения, легких, плевры) [8, 11, 37 - 39]. ЕОК I C (УУР C, УДД 5).
- Прицельная рентгенография органов грудной клетки рекомендуется пациентам с подозрением на ИБС и сердечную недостаточность для определения наличия и выраженности нарушений внутрилегочной гемодинамики (венозного застоя, легочной артериальной гипертензии), а также свободной жидкости в плевральных полостях [8, 11, 37 - 39]. ЕОК IIa C (УУР C, УДД 2).
Суточное мониторирование ЭКГ (Холтеровское)
- Холтеровское мониторирование сердечного ритма рекомендуется пациентам с ИБС или подозрением на ИБС и сопутствующими нарушениями ритма и/или проводимости с целью выявления последних и, при необходимости, подбора терапии [37 - 39]. ЕОК I C (УУР C, УДД 2).
- Холтеровское мониторирование сердечного ритма рекомендуется пациентам с болью в грудной клетке при подозрении на вазоспастическую стенокардию с целью регистрации характерных изменений на ЭКГ [37 - 39]. ЕОК IIa C (УУР C, УДД 2).
- Мониторирование ЭКГ не рекомендуется для выявления ишемии у пациентов с подозрением на ИБС [37 - 39]. ЕОК III B (УУР C, УДД 2).
Комментарий. Метод позволяет определить частоту возникновения, продолжительность и условия возникновения нарушений ритма сердца и проводимости. Мониторирование ЭКГ позволяет документировать изменения на ЭКГ, связанные с вазоспазмом. При мониторировании ЭКГ может быть обнаружена депрессия сегмента ST, ранее предлагаемая к трактовке как признак транзиторной ишемии миокарда. Однако депрессия ST при мониторировании не взаимосвязана с неблагоприятным прогнозом, не дает дополнительной информации по сравнению с нагрузочными тестами и часто даже не подтверждается как признак преходящей ишемии при проведении визуализирующих нагрузочных тестов [37 - 39]. Мониторирование ЭКГ не может быть использовано для диагностики ишемии миокарда даже при отсутствии условий для проведения других методов диагностики, поскольку отрицательные результаты исследования не исключают наличие ИБС.
Компьютерная томография (КТ) для оценки коронарного кальциноза
- Пациентам с подозрением на ИБС для выявления факторов, модифицирующих ПТВ ИБС, может быть рекомендована оценка коронарного кальция с помощью компьютерной томографии сердца (при наличии возможности) с расчетом индекса Агатсона [21, 40 - 42]. ЕОК IIb B (УУР B, УДД 2).
Комментарий. Оценка коронарного кальциноза целесообразна как метод понижения вероятности ИБС при значении коронарного кальция, равного 0, и метод, повышающий вероятность ИБС, при обнаружении коронарного кальция.
Нагрузочная ЭКГ
- У пациентов с подозрением на ИБС для выявления факторов, модифицирующих ПТВ ИБС, рекомендуется проведение нагрузочного ЭКГ-теста, выполненного на фоне отмены антиишемической терапии (при наличии возможности) [21, 42]. ЕОК IIb B (УУР C, УДД 5).
Комментарий. Отрицательный нагрузочный тест является признаком, снижающим вероятность ИБС. При положительном или сомнительном нагрузочном тесте (появлении стенокардии, ЭКГ-признаков ишемии миокарда, низкой толерантности к физической нагрузке (ТФН)) вероятность ИБС повышается.
Интерпретация ПТВ ИБС и данных первичного обследования при подозрении на ИБС. Дополнительное специфическое обследование для подтверждения диагноза ИБС
Выбор дальнейшей стратегии обследования больного с подозрением на ИБС зависит от ПТВ ИБС и данных первичного обследования (анамнеза, физикального и лабораторного исследования, ЭКГ в покое, ЭхоКГ в покое и проведенных по показаниям и при возможности рентгенографии грудной клетки, мониторирования ЭКГ, оценки коронарного кальциноза и нагрузочной ЭКГ, модифицирующих ПТВ ИБС. На основании этих данных принимается решение о необходимости выполнения дополнительных специфических неинвазивных и инвазивных тестов, имеющих высокую чувствительность при диагностике ИБС.
Факторы, модифицирующие предтестовую вероятность ИБС
- Факторами, которые модифицируют ПТВ ИБС и повышают ее, рекомендуется считать: ФР ССЗ (семейный анамнез ССЗ, дислипидемию, сахарный диабет, гипертензию, курение, ожирение); наличие зубца Q или изменения сегмента ST-T на ЭКГ, дисфункцию ЛЖ, патологическую нагрузочную ЭКГ и кальциноз коронарных артерий [40 - 42]. ЕОК I C (УУР B, УДД 2).
- Факторами, которые модифицируют ПТВ ИБС и снижают ее, рекомендуется считать: отрицательные результаты нагрузочной ЭКГ; отсутствие коронарного кальция при компьютерной томографии (индекс Агатстона = 0) [40 - 42]. ЕОК I C (УУР B, УДД 2).
Комментарий. Клинические факторы, модифицирующие ПТВ ИБС, не являются самостоятельными специфическими признаками ИБС, но повышают или понижают вероятность заболевания и риск развития ССО [40 - 42].
Оценка ПТВ ИБС, первичное обследование пациентов с подозрением на ИБС и решение о необходимости выполнения дополнительных специфических методов диагностики должны быть выполнены на уровне первичного звена здравоохранения.
Специфические методы диагностики ИБС и выбор метода в зависимости от ПТВ ИБС и модифицирующих факторов
- Пациентам с очень низкой ПТВ ИБС (< 5%) при отсутствии факторов, повышающих ПТВ ИБС (раздел 2.4.2.2), факторов высокого риска сердечно-сосудистых осложнений (раздел 2.5) или наличии факторов, снижающих ПТВ ИБС (раздел 2.4.2.2), рекомендуется ограничиться проведенной оценкой ПТВ ИБС и первичным обследованием, позволяющими убедительно отвергнуть диагноз ИБС [19]. ЕОК I C (УУР B, УДД 2).
- Пациентам с очень низкой ПТВ ИБС (< 5%) и факторами высокого риска ССО (раздел 2.5) рекомендуется проведение дополнительных специфических неинвазивных визуализирующих диагностических тестов для подтверждения или исключения диагноза ИБС [19]. ЕОК I C (УУР B, УДД 2).
Комментарий. При очень низкой ПТВ (< 5%) и отсутствии факторов, повышающих ПТВ ИБС, подавляющее большинство больных в популяционных исследованиях не имеют стенозов коронарных артерий (КА) > 50% и сниженного фракционного резерва кровотока (ФРК, <= 0,80) при последующем инвазивном обследовании. Поэтому оценки ПТВ ИБС и первичных симптомов достаточно, чтобы убедительно отвергнуть ИБС. Дополнительное использование неинвазивных визуализирующих методов не повышает диагностическую точность в этой группе, но существенно увеличивает стоимость и длительность диагностики [19].
- Пациентам с низкой ПТВ ИБС (5 - 15%) и типичными симптомами и/или факторами, повышающими ПТВ (раздел 2.4.2.2), и/или факторами высокого риска ССО (раздел 2.5) рекомендуется проведение дополнительных специфических неинвазивных визуализирующих тестов для подтверждения или исключения диагноза ИБС [43 - 44]. ЕОК I C (УУР B, УДД 2).
Комментарий: При низкой ПТВ (5 - 15%) большинство больных в популяционных исследованиях также не имеют стенозов коронарных артерий (КА) > 50% и сниженного фракционного резерва кровотока (ФРК, <= 0,80) при последующем инвазивном обследовании. Однако проведение дополнительных неинвазивных визуализирующих методов диагностики у пациентов с ФР ССЗ и/или изменениями на ЭКГ покоя или нагрузки способны повысить точность диагностики гемодинамически значимых коронарных стенозов [43 - 44].
- Пациентам с умеренной ПТВ ИБС (> 15%) рекомендуется проведение дополнительных специфических неинвазивных визуализирующих тестов для подтверждения или исключения диагноза ИБС [8, 19]. ЕОК I C (УУР B, УДД 2).
- В качестве первого неинвазивного визуализирующего теста для диагностики ИБС рекомендуется один из неинвазивных визуализирующих стресс-методов выявления ишемии миокарда (эхокардиография с физической нагрузкой, или с чреспищеводной стимуляцией (ЧПЭС), или с фармакологической нагрузкой; или сцинтиграфия миокарда с функциональными пробами, или позитронно-эмиссионная томография миокарда, или однофотонная эмиссионная компьютерная томография миокарда перфузионная с функциональными пробами) [45, 224 - 227]. ЕОК I B (УУР B, УДД 1).
- Неинвазивные визуализирующие стресс-методы выявления ишемии миокарда не рекомендуются для диагностики ИБС пациентам с абсолютными противопоказаниями к проведению нагрузочных исследований [8, 11]. ЕОК III B (УУР B, УДД 5).
Комментарий. Визуализирующие стресс-методы диагностики предназначены для выявления ишемии миокарда путем оценки ЭКГ-изменений, нарушений локальной сократимости стенки (при ЭхоКГ и МРТ) или нарушений перфузии (при ОФЭКТ, ПЭТ, миокардиальной контрастной ЭхоКГ или контрастной МРТ). Ишемия провоцируется физической нагрузкой на тредмиле/велоэргометре, учащающей чреспищеводной электрокардиостимуляцией или фармакологическими стресс-агентами, которые повышают работу сердца и потребность в кислороде (добутамин**) или провоцируют гетерогенность миокардиальной перфузии при вазодилатации (трифосаденин (C.01.E.B.10), дипиридамол). Методы позволяют не только установить факт ишемии, но и предварительно определить симптом-связанную КА по локализации преходящей дисфункции или преходящего дефекта перфузии ЛЖ [45]. Стресс-ЭхоКГ проводится со всеми типами стресс-агентов, стресс-ОФЭКТ и стресс-ПЭТ выполняются с физической нагрузкой и вазодилататорами (аденозином фосфатом (C.01.E.B.10) дипиридамолом), а стресс-МРТ - только с фармакологическими агентами. Методы оценки движения стенки (стресс-ЭхоКГ, стресс-МРТ) предоставляют дополнительную информацию о динамике глобальной и региональной сократительной, насосной и диастолической функции ЛЖ, методы оценки перфузии позволяют оценить систолическую функцию ЛЖ, объем, выраженность и протяженность зоны рубца. Неинвазивные визуализирующие стресс-методы имеют высокую диагностическую точность при выявлении гемодинамически значимых стенозов в сравнении с инвазивным тестированием (оценкой ФРК, Измерение фракционного резерва коронарного кровотока), поскольку обе группы методов направлены на оценку функциональной значимости поражения. При отрицательных результатах визуализирующего стресс-теста вероятность наличия гемодинамически значимых стенозов (ФРК, <= 0,80) минимальная. Кроме того, неинвазивные функциональные стресс-тесты одновременно позволяют провести стратификацию риска ССО и принять решение о тактике лечения, которые требуются большинству пациентов на следующем этапе диагностики. Визуализирующие стресс-методы не применяются в случае, когда пациент имеет противопоказания к проведению нагрузочных исследований.
- В качестве первого неинвазивного визуализирующего теста для диагностики ИБС, как альтернатива неинвазивным визуализирующим стресс-тестам, рекомендуется мультиспиральная компьютерная томография (МСКТ) коронарных артерий (МСКТА КА, компьютерно-томографическая коронарография) или МСКТА КА, дополненная МСКТ-оценкой перфузии (компьютерная томография сердца с контрастированием) [46 - 48]. ЕОК I B (УУР B, УДД 1).
- Пациентам с высоким кальциевым индексом, нерегулярным ритмом, при ЧСС > 80 ударов в минуту, с выраженным ожирением, невозможностью следовать командам задержки дыхания и другими состояниями, при которых невозможно получение качественных изображений, не рекомендуется проводить МСКТ-ангиографию КА [46, 48]. ЕОК III C (УУР A, УДД 1).
- У больных с ИБС при выраженном кальцинозе КА по результатам МСКТ не рекомендуется оценивать степень их стенозирования [46, 48]. ЕОК III C (УУР A, УДД 1).
Комментарий. МСКТ коронарных артерий с контрастированием (МСКТА КА) позволяет оценить анатомию, просвет, стенку КА, а также локализацию, структуру и поверхность атеросклеротических бляшек. Метод имеет высокую точность диагностики стенозов > 50% в сравнении с КАГ, поскольку оба метода базируются на оценке структуры коронарных артерий. При отрицательных результатах МСКТА КА вероятность наличия стенозов > 50% (анатомически значимых) минимальная. Однако если при МСКТА КА обнаружены стенозы КА >= 50%, метод позволяет одновременно стратифицировать риск ССО и принять решение о тактике лечения, при условии наличия в медицинском учреждении возможности проведения МСКТ с перфузией в стресс-тесте (фармакологическая проба с аденозином фосфатом (C.01.E.B.10) или его производными). В соответствии с согласованным мнением экспертов, МСКТА КА должны подвергаться только пациенты со способностью адекватной задержки дыхания, без тяжелого ожирения, с синусовым ритмом и низкой вероятностью реваскуляризации миокарда. Частота сердечных сокращений должна быть снижена с помощью бета-адреноблокаторов, оптимально менее чем 60 ударов в минуту. Для достижения коронарной вазодилатации до исследования дают органические нитраты сублингвально. Нерегулярный ритм, выраженный кальциноз коронарных артерий, предшествующая реваскуляризация (АКШ, стентирование) снижают вероятность получения изображения хорошего качества при МСКТ и влияют на диагностическую точность метода. Широкое внедрение МСКТА КА в настоящее время ограничивается техническими возможностями лечебных учреждений, наличием экспертных специалистов и стоимостью исследования.
- Пациентам с ИБС или подозрением на ИБС рекомендуется рассмотреть нагрузочную ЭКГ (ЭКГ с физической нагрузкой на тредмиле или велоэргометре), выполненную на фоне отмены антиишемической терапии, как альтернативный тест для верификации ишемии в случае, когда визуализирующие методы (стресс-методы визуализации или МСКТ-ангиография) технически не могут быть проведены [48 - 50]. ЕОК IIb B (УУР A, УДД 1).
Комментарий. Ранее нагрузочная ЭКГ была рекомендована для опосредованной оценки ишемии миокарда на основании появления изменений сегмента ST во время нагрузки на тредмиле или велоэргометре. Основным диагностическим ЭКГ-признаком ишемии является горизонтальная или косонисходящая депрессия сегмента ST >= 0,1 мВ продолжительностью по крайней мере 0,06 - 0,08 секунд от точки J в одном или более ЭКГ-отведении и появление типичной стенокардии умеренной и высокой интенсивности. В недавнем метаанализе чувствительность и специфичность нагрузочной ЭКГ для диагностики ИБС, определенной как стеноз КА >= 50%, составила 58% и 62%, соответственно. Ряд других исследований показал еще более низкую чувствительность (45 - 50%), но более высокую специфичность метода (85 - 90%). Нагрузочная ЭКГ имеет более низкие диагностические возможности по сравнению с визуализирующими стресс-методами как в подтверждении, так и в исключении диагноза стенозирующего коронарного атеросклероза [48]. В недавних рандомизированных клинических исследованиях было показано, что добавление визуализирующего стресс-метода или МСКТА КА к нагрузочной ЭКГ позволяет дополнительно уточнить диагноз, более целенаправленно назначить лекарственную терапию, выполнить реваскуляризацию миокарда и снизить потенциальный риск острого инфаркта миокарда (ОИМ) [49, 50]. Поэтому в настоящем документе рекомендовано использовать диагностические визуализирующие методы вместо нагрузочной ЭКГ как первые для диагностики значимой ИБС. Нагрузочная ЭКГ может быть использована как альтернативный тест для подтверждения или исключения ИБС, если использование визуализирующих методов невозможно по техническим причинам. Для получения максимальной диагностической информации тест следует проводить до появления симптомов/признаков, ограничивающих его, и помнить о высоком риске ложноотрицательных и ложноположительных результатов. Положительный результат теста в виде появления депрессии сегмента ST или низкой ТФН является дополнительным фактором, усиливающим клиническую вероятность ИБС и показанием для проведения дополнительных специфических методов диагностики ИБС.
- Нагрузочная ЭКГ не рекомендуется как тест для диагностики ИБС у пациентов с депрессией сегмента ST глубиной >= 0,1 мВ на ЭКГ покоя или получающих сердечные гликозиды, и/или имеющих выраженное снижение ФВ ЛЖ (<= 30%) [8, 49]. ЕОК III C (УУР A, УДД 2).
Комментарий. Нагрузочная ЭКГ является недиагностической при наличии полной блокады левой ножки пучка Гиса, ритме ЭКС и синдроме WPW, при которых изменения сегмента ST-T не могут быть интерпретированы. Кроме того, ложноположительные результаты часто обнаруживаются у пациентов с аномалиями ЭКГ в покое вследствие гипертрофии ЛЖ, электролитного дисбаланса, внутрижелудочковых нарушений проводимости, фибрилляции предсердий и при применении сердечных гликозидов и без антиишемической терапии. В этом случае могут быть использованы только методы неинвазивной визуализации или инвазивные методы.
- Изолированная оценка коронарного кальция при МСКТА не рекомендуется для диагностики ИБС [46, 48]. ЕОК III C (УУР A, УДД 1).
Комментарий. Изолированная оценка коронарного кальция, особенно в старших возрастных группах, имеет невысокую точность при диагностике стенозов > 50%.
Выбор неинвазивного визуализирующего метода диагностики
- Выбор первого неинвазивного визуализирующего метода рекомендуется проводить на основании ПТВ ИБС, особенностей пациента и собственно метода диагностики (переносимость нагрузки, вероятность получения изображения хорошего качества, наличие лучевой нагрузки, риски и противопоказания), технических возможностей медицинской организации и уровня квалификации специалистов [51 - 53]. ЕОК I C (УУР C, УДД 4).
- У пациентов с более низкой ПТВ ИБС (<= 15%), низкой вероятностью реваскуляризации, ожидаемым изображением высокого качества, противопоказаниями к проведению нагрузочных тестов при наличии технической возможности и специалистов рекомендуется выбирать МСКТА КА в качестве первого специфического неинвазивного метода диагностики ИБС [51 - 53]. ЕОК IIa C (УУР C, УДД 4).
- У пациентов с более высокой ПТВ ИБС (> 15%), высокой вероятностью выполнения реваскуляризации, необходимостью оценки жизнеспособности миокарда при наличии технической возможности и специалистов рекомендуется выбирать один из визуализирующих нагрузочных стресс-методов в качестве первого специфического неинвазивного метода диагностики ИБС (эхокардиография с физической нагрузкой, или эхокардиография с фармакологической нагрузкой, или сцинтиграфия миокарда с функциональными пробами, или позитронно-эмиссионная томография миокарда, или однофотонная эмиссионная компьютерная томография миокарда, перфузионная с функциональными пробами) [51 - 53]. ЕОК I C (УУР C, УДД 4).
- Визуализирующий нагрузочный стресс-метод диагностики ишемии миокарда (эхокардиография с физической нагрузкой, или эхокардиография с фармакологической нагрузкой, или сцинтиграфия миокарда с функциональными пробами, или позитронно-эмиссионная томография миокарда, или однофотонная эмиссионная компьютерная томография миокарда, перфузионная с функциональными пробами) рекомендуется (при наличии возможности) в качестве второго неинвазивного метода диагностики пациентам с нетяжелыми симптомами, у которых при МСКТА были диагностированы стенозы с неясной функциональной значимостью (50 - 90%) или метод оказался неинформативен [51 - 53]. ЕОК I B (УУР C, УДД 4).
- Компьютерно-томографическая коронарография рекомендуется (при наличии возможности) в качестве второго неинвазивного метода диагностики пациентам, у которых визуализирующий стресс-тест оказался неинформативным или сомнительным [51 - 53]. ЕОК IIa A (УУР C, УДД 4).
Комментарий. На выбор неинвазивного визуализирующего метода влияет ПТВ ИБС. МСКТ-ангиография является несколько более предпочтительным методом у пациентов с наиболее низкими значениями умеренной ПТВ (до 16%), потому что имеет наибольшую силу для исключения диагноза ИБС. Так, МСКТ демонстрирует очень высокую чувствительность при выявлении стенозов КА > 50% (95,6%), но умеренную специфичность (81,5%). Отсутствие стенозов при МСКТ ассоциировано с очень хорошим прогнозом. МСКТ предполагает воздействие ионизирующего излучения, что должно быть принято во внимание у молодых пациентов и женщин репродуктивного возраста. Необходимо также взвешивать риски от введения йодсодержащих контрастных агентов. Неинвазивные визуализирующие стресс-методы наиболее важны для подтверждения диагноза ИБС и являются предпочтительными у пациентов с более высокими значениями умеренной ПТВ (более 15%), имеющих большую вероятность реваскуляризации, поскольку позволяют одновременно провести стратификацию риска ССО. Методы оценки функциональной значимости стенозов ассоциированы с более редким назначением КАГ, по сравнению со стратегией, основанной на МСКТ.
Выбор в группе стресс-методов визуализации. Оценка функциональной значимости стенозов возможна с помощью целой группы неинвазивных визуализирующих стресс-методов: стресс-ЭхоКГ, стресс-МРТ, стресс-ОФЭКТ, или стресс-ПЭТ. Наиболее доступными и используемыми служат стресс-ЭхоКГ и стресс-ОФЭКТ.
Стресс-ЭхоКГ является одним из самых востребованных и высокоинформативных методов неинвазивной диагностики ИБС и выполняется с использованием всех типов стресс-агентов. В основе метода лежит визуальное выявление НЛС, как эквивалента ишемии. Стресс-ЭхоКГ обладает чувствительностью 80 - 85-процентной специфичностью, 84 - 86% в диагностике стенозов > 50%. Основными преимуществами стресс-ЭхоКГ по сравнению с другими функциональными тестами является ее доступность, более низкая стоимость, лучшее соотношение стоимость/эффективность, возможность одновременной оценки ишемии и систолической, диастолической функции ЛЖ и функции клапанов сердца. Технология не связана с воздействием ионизирующего излучения, но при этом обеспечивает такую же диагностическую и прогностическую точность, как радионуклидные стресс-методы и стресс-МРТ. Основные трудности, связанные со стресс-ЭхоКГ, - это существенная зависимость качества экспертизы от опыта исследователя, и визуальная оценка нарушений локальной сократимости. Точность диагностики при стресс-ЭхоКГ повышает использование эхоконтрастных препаратов по показаниям. Оценка коронарного резерва в передней нисходящей коронарной артерии (ПНА) имеет дополнительное к НЛС диагностическое и прогностическое значение при стенозах > 50% и микрососудистом поражении. Значение оценки технологий деформации и трехмерной реконструкции при стресс-ЭхоКГ для качества диагностики ИБС и прогноза не согласовано экспертами.
При ОФЭКТ перфузионное изображение миокарда обеспечивается региональным захватом радиофармацевтического препарата (РФП), который определяется относительным миокардиальным кровотоком в покое и во время стресса. При ОФЭКТ в качестве стресс-агента выступают физическая нагрузка и фармакологические стресс-агенты. Метод предоставляет информацию о наличии и отсутствии ишемии миокарда, ее локализации и выраженности, рубцовых изменениях, жизнеспособности миокарда и желудочковой функции. Общая чувствительность стресс-ОФЭКТ для диагностики стенозов > 50% составляет 87% и специфичность 70%, для диагностики функционально значимых стенозов (ФРК <= 0,80) 73 - 74% и 79 - 83% соответственно. При исследовании с наиболее часто используемыми радиофармацевтическими препаратами (на основе технеция-99m) лучевая нагрузка на пациента составляет приблизительно 10 мЗв, но может быть уменьшена в 2 раза при оценке изображения только на пике нагрузки и проведении исследования на ОФЭКТ-камерах нового типа. Однако наличие лучевой нагрузки следует принимать во внимание у молодых пациентов и женщин репродуктивного возраста.
Для получения перфузионного изображения при ПЭТ используются радиофармацевтические препараты, тропные к миокарду, установленные действующим перечнем лекарственных средств. Подобно ОФЭКТ, ПЭТ-технология предоставляет информацию о наличии или отсутствии ишемии миокарда, ее локализации и выраженности, наличии рубца и желудочковой функции. В сравнении с ОФЭКТ, ПЭТ имеет более высокое качество изображения, уникальные возможности по расчету кровотока в мл/мин/г, который позволяет неинвазивно оценивать резерв кровотока, и обеспечивает более низкую лучевую нагрузку на пациента (примерно 1 - 4 мЗв) из-за более короткого периода полураспада ПЭТ-трейсеров. Суммарная чувствительность ПЭТ при диагностике стенозов > 50% составляет 90%, специфичность 85%, при диагностике гемодинамически значимых стенозов (ФРК, <= 0,80) 89% и 85% соответственно, что несколько, хотя и незначимо, выше, чем у стресс-ЭхоКГ и стресс-ОФЭКТ. Однако ПЭТ в целом меньше используется из-за малой доступности и существенно более высокой стоимости.
Стресс-МРТ может быть выполнена с фармакологическими стресс-агентами (чаще вазодилататорами) путем оценки миокардиальной перфузии и/или изменений движения стенки ЛЖ в ответ на стресс. Анализ проводится как путем визуальной оценки полей с низким сигналом, связанных со снижением перфузии, так и с помощью различных программных инструментов. Предприняты попытки полуколичественной и количественной оценки перфузии при МРТ, однако клиническое применение этих инструментов остается неясным. Основными недостатками метода являются низкая доступность, необходимость в экспертах с очень высокой квалификацией, неколичественный анализ и высокая стоимость. При контрастной МРТ необходимо взвешивать риск введения гадолиния. В конечном итоге ключевыми факторами, влияющими на выбор стресс-метода визуализации, будут: доступность выполнения, специфические показания и особенности пациента, наличие экспертов, лучевая нагрузка и стоимость.
Выбор типа стресс-агента при визуализирующих стресс-методах. Необходимо выбрать не только метод, но и оптимальный стресс-агент, который предоставит наиболее полную информацию при наименьшем риске. Тредмил-тест и велоэргометрия, с одной стороны, являются наиболее физиологическими вариантами нагрузки, с другой, особенно предпочтительны в случаях, когда дополнительно необходимо получить информацию о толерантности к физической нагрузке, уровне ЧСС на нагрузке, и при оценке отдельных профессиональных категорий (пилоты, спортсмены, др.). Методом визуализации в этих случаях могут выступать только ЭхоКГ и ОФЭКТ. С другой стороны, пробы с физической нагрузкой не всегда могут быть проведены у пациентов с перемежающейся хромотой, заболеваниями опорно-двигательного аппарата, артериальной гипертензией, при детренированности, ряде других. У пациентов, которые не могут выполнить полный тест с нагрузкой, имеют противопоказания к нагрузке или выраженные изменения конечной части желудочкового комплекса на ЭКГ выбор должен быть сделан между фармакологическими стресс-агентами. Применение в качестве стресс-агента добутамина наиболее оправдано у лиц с исходными НЛС ЛЖ. Аденозин фосфат (C.01.E.B.10 и дипиридамол хорошо зарекомендовали себя не только при диагностике стенозов КА, но и микрососудистой дисфункции. Необходимо также взвешивать риски и пользу различных диагностических тестов у индивидуума и противопоказания и противопоказания к фармакологическим стресс-агентам.
Методы диагностики у больного с установленным диагнозом ИБС
- Регистрация электрокардиограммы, расшифровка, описание и интерпретация электрокардиографических данных, эхокардиография трехмерная в состоянии покоя с использованием допплеровских режимов и оценкой ФВ ЛЖ рекомендуется пациентам с установленным диагнозом ИБС, в том числе после реваскуляризации миокарда, при прогрессировании сердечных симптомов, несмотря на оптимальную медикаментозную терапию и/или появление новых симптомов [8, 11]. ЕОК I C (УУР C, УДД 5).
- Прицельная рентгенография органов грудной клетки рекомендована пациентам с установленным диагнозом ИБС при подозрении на развитие СН [8, 11, 54 - 55]. ЕОК I C (УУР C, УДД 5).
- Холтеровское мониторирование сердечного ритма рекомендовано пациентам с доказанной стабильной ИБС и подозрением на сопутствующую аритмию [21, 37 - 39]. ЕОК I C (УУР B, УДД 2).
- МСКТА КА артерий не рекомендуется использовать как рутинный метод контроля у асимптомных пациентов с известным анамнезом атеросклеротического поражения коронарных артерий [48, 54 - 55]. ЕОК III C (УУР A, УДД 1).
- Неинвазивные визуализирующие стресс-методы (эхокардиография с физической нагрузкой, или с ЧПЭС, или с фармакологической нагрузкой, или сцинтиграфия миокарда с функциональными пробами, или позитронно-эмиссионная томография миокарда, или однофотонная эмиссионная компьютерная томография миокарда перфузионная, с функциональными пробами, если технические возможности и экспертный уровень специалистов позволяют их проведение) или как альтернатива ЭКГ с физической нагрузкой на тредмиле или велоэргометре (если тест доведен до диагностических критериев и ЭКГ позволяет оценить ишемические изменения) рекомендованы для стратификации риска ССО у пациентов с установленным диагнозом ИБС, в том числе после реваскуляризации миокарда, при увеличении частоты и тяжести сердечных симптомов, когда потенциально возможна и планируется реваскуляризация для улучшения прогноза [54 - 55]. ЕОК I B (УУР C, УДД 5).
- При невозможности проведения неинвазивных стресс-тестов, КАГ, дополненная измерением ФРК или МРК, рекомендуется для оценки состояния коронарного русла у пациентов, у которых имеются симптомы заболевания, несмотря на оптимальную медикаментозную терапию, данные неинвазивных методов диагностики указывают на высокий риск ССО и обсуждается возможность реваскуляризации для улучшения прогноза [56, 57]. ЕОК I A (УУР A, УДД 1).
- Нагрузочная ЭКГ (или ЭКГ с физической нагрузкой на тредмиле или велоэргометре) рекомендована пациентам с установленным диагнозом ИБС для оценки ТФН, симптомов, нарушений ритма сердца, ответа АД и риска событий при стабильном течении заболевания и решении экспертных вопросов [8, 11, 21]. ЕОК I C (УУР C, УДД 5).
- Нагрузочная ЭКГ (или ЭКГ с физической нагрузкой на тредмиле или велоэргометре) может быть рекомендована пациентов с установленным диагнозом ИБС, получающих лечение, для оценки влияния лечения на симптомы и ишемию миокарда [8, 11, 21]. ЕОК IIb C (УУР C, УДД 5).
Комментарий: Нагрузочная ЭКГ может быть полезным методом для оценки эффективности медикаментозного лечения, а также динамической оценки симптомов и толерантности к нагрузке после реваскуляризации миокарда. Однако крупных рандомизированных исследований о положительном влиянии повторных нагрузочных исследований на ССО не выполнено.
2.4.2 Инвазивные методы обследования при стабильной ИБС
Инвазивная коронарная ангиография
Коронарная ангиография (КАГ, коронарография) - это инвазивное диагностическое исследование, выполняемое в условиях рентгенооперационной путем введения контрастного вещества в устья коронарных артерий под рентгенологическим контролем. Традиционно используется в диагностике ИБС и при стратификации риска осложнений, для выявления стенозов в коронарных артериях, их локализации, протяженности и выраженности, а также, в ряде случаев, - для обнаружения участков нестабильности атеросклеротических бляшек (АСБ) [8, 11, 19, 58].
При наличии клиники стенокардии
- При доказанной ИБС КАГ рекомендуется для стратификации риска ССО у пациентов с тяжелой стабильной стенокардией (ФК III - IV) или с клиническими признаками высокого риска ССО, особенно когда симптомы плохо поддаются медикаментозной терапии, в том числе и без предшествующего стресс-тестирования [8, 11, 56 - 58]. ЕОК I B (УУР B, УДД 1).
- Инвазивное измерение фракционного резерва коронарного кровотока (ФРК, iFR) рекомендуется при отсутствии данных нагрузочного стресс-тестирования для определения показаний к реваскуляризации, кроме стенозов > 90% при наличии технических возможностей и специалистов [59]. ЕОК I B (УУР A, УДД 1).
Комментарий. Для обоснованного проведения КАГ необходимо учитывать весь комплекс данных, полученных в ходе расспроса, осмотра и неинвазивных инструментальных исследований. Наиболее оправдано проведение КАГ пациентам с высоким риском тяжелых ССО, - поскольку в ходе исследования у таких пациентов обычно принимается решение о способе реваскуляризации миокарда с целью снижения этого риска. При низком риске ССО проведение КАГ нецелесообразно, поскольку ее результаты обычно не оказывают влияния на ход лечения и, соответственно, не изменяют прогноз. При отсутствии данных нагрузочного стресс-тестирования при стенозах менее 90% рекомендуется измерение фракционного резерва кровотока или iFR [59]. В отдельных случаях, при необходимости, КАГ дополняют проведением внутрикоронарного ультразвукового исследования [8, 11, 19, 58]. В практике используют классификацию по количеству пораженных сосудов (однососудистое, двухсосудистое, трехсосудистое поражение КА) [60]. Доказано, что неблагоприятная прогностическая роль стенозов в проксимальных отделах КА выше, чем роль стенозов в дистальных участках [8, 9, 11, 19]. Отдельно выделяют группы больных со стенозированием ствола левой КА и проксимальной части передней нисходящей артерии (ПНА). Из-за неблагоприятного прогностического значения таких поражений этим больным настоятельно рекомендуют проведение реваскуляризации миокарда. Важным аспектом является определение функциональной значимости коронарных стенозов. Значения ФРК <= 0.80 и iFR <= 0,89 являются независимыми предикторами высокого риска ССО [25, 59].
- Проведение КАГ с возможностью измерения фракционного резерва коронарного кровотока или iFR (instantaneous wave-free ratio) рекомендовано для стратификации риска ССО у пациентов с неинформативными или противоречивыми результатами неинвазивных исследований [61 - 63]. ЕОК IIa B (УУР B, УДД 2).
- Проведение КАГ рекомендуется для переоценки выраженности стенозирования КА при выявленном тяжелом кальцинозе, по данным мультиспиральной компьютерной томографической ангиографии (МСКТА) КА - особенно у пациентов с высокой или промежуточной предтестовой вероятностью стабильной ИБС [50, 51]. ЕОК IIa C (УУР B, УДД 2).
При отсутствии клиники стенокардии и/или бессимптомном течении заболевания
- При отсутствии возможности получения данных нагрузочного стресс-тестирования КАГ, дополненная измерением фракционного резерва коронарного кровотока (ФРК или iFR), рекомендуется для определения состояния коронарного русла у больных со слабовыраженными симптомами или с бессимптомным течением заболевания, на фоне медикаментозной терапии, у которых данные неинвазивных методов исследования указывают на высокий риск ССО, и обсуждается возможность реваскуляризации для улучшения прогноза [57, 58] при наличии технической возможности. ЕОК I A (УУР A, УДД 2).
- Выполнение рентгенконтрастной вентрикулографии сердца в двух проекциях во время КАГ рекомендуется при неинформативности предшествующей трансторакальной ЭхоКГ для оценки общей и локальной сократимости ЛЖ, а также пациентам с постинфарктной аневризмой ЛЖ, которым планируется реконструктивная операция на левом желудочке сердца [58, 64]. ЕОК IIa C (УУР C, УДД 5).
Комментарий. Значение выявленной при вентрикулографии дисфункции ЛЖ очень важно для прогнозирования выживаемости больных со всеми формами ИБС.
- Проведение КАГ рекомендуется пациентам с длительным анамнезом ИБС с высоким риском ССО при появлении признаков ишемии по данным неинвазивного стресс-тестирования и/или выраженных симптомах ишемии (стенокардия напряжения III - IV ФК), а также при необъяснимом снижении локальной сократимости миокарда ЛЖ [59]. ЕОК I C (УУР A, УДД 2).
Малоизмененные/неизмененные коронарные артерии и вазоспастическая стенокардия
- У пациентов с симптомами ишемии миокарда и неизмененными или малоизмененными КА при коронарной ангиографии для исключения микрососудистой стенокардии рекомендуется:
А) внутрикоронарное измерение кровотока с помощью допплеровского датчика (Измерение фракционного резерва коронарного кровотока). ЕОК IIa C (УУР B, УДД 3) [65, 66].
Б) рекомендуется рассмотреть возможность внутрикоронарного введения ацетилхолина хлорида (S01EB09) и аденозина фосфата (C.01.E.B.10) при проведении КАГ для оценки эндотелий-зависимого и эндотелий-независимого резерва коронарного кровотока и верификации спазма эпикардиальных артерий и мелких сосудов. ЕОК IIb C (УУР B, УДД 3). [67 - 69]
- Проведение КАГ или МСКТА КА рекомендуется при подозрении на вазоспастическую стенокардию пациентам с характерными изменениями сегмента ST и клиникой стенокардии покоя, купирующейся приемом органических нитратов и/или АК, для исключения атеросклеротического поражения коронарных артерий [70, 71]. ЕОК I C (УУР C, УДД 5).
- При подозрении на вазоспастическую стенокардию у лиц с нормальными или малоизмененными, по данным КАГ, коронарными артериями рекомендуется проведение провокационных внутрикоронарных фармакологических проб для выявления спазма КА во время КАГ [57, 66 - 69, 72]. ЕОК IIa C (УУР B, УДД 2).
Комментарий. Провокационные диагностические пробы небезопасны, поэтому их проводят в условиях палаты (отделения) интенсивного наблюдения или смежной ангиографической лаборатории через центральный венозный, либо интракоронарный катетер. Учитывая, что длительный спазм поврежденных коронарных артерий может вызвать ИМ, провокационные пробы проводят только при интактных или малоизмененных КА, выявленных в ходе КАГ.
Основные пробы для выявления вазоспастической стенокардии - внутрикоронарное введение ацетилхолина хлорида (S01EB09), аденозина фосфата (C.01.E.B.10), допамина гидрохлорид (C01CA04) [70].
Другие показания для исследования коронарных артерий
- Проведение КАГ рекомендуется перед оперативным лечением клапанной патологии сердца при наличии любого из нижеперечисленных признаков: анамнеза сердечно-сосудистых заболеваний (указание на наличие стенокардии), подозрения на ишемию миокарда, систолической дисфункции левого желудочка, у мужчин старше 40 лет и женщин в постменопаузальном периоде, а также при наличии одного или нескольких факторов риска ССО [73]. ЕОК I C (УУР C, УДД 5).
- Проведение КАГ рекомендуется пациентам с митральной регургитацией средней и тяжелой степени [73]. ЕОК I C (УУР C, УДД 5).
- Проведение МСКТА КА рекомендуется к рассмотрению как альтернатива КАГ перед операцией на клапанах сердца у пациентов с тяжелыми клапанными пороками и низкой вероятностью поражений коронарных артерий [73]. ЕОК IIa C (УУР C, УДД 5).
- КАГ у пациентов после трансплантации сердца рекомендуется выполнять ежегодно в течение 5 лет после трансплантации, и в дальнейшем при отсутствии гемодинамически значимых поражений КА - раз в 2 года [74 - 76]. ЕОК IIa B (УУР C, УДД 5).
Дополнительные методы исследования коронарных артерий
Внутрисосудистое ультразвуковое исследование коронарных артерий и оптико-когерентная томография
- Внутрисосудистое ультразвуковое исследование сосудистой стенки и оптическая когерентная томография коронарных артерий рекомендуются к применению при стабильной ИБС у пациентов с поражением ствола ЛКА при отсутствии возможности получения данных нагрузочного стресс-тестирования и/или определения функциональной значимости с помощью измерения ФРК, iFR и для оптимизации результатов стентирования ствола ЛКА [11, 60, 77 - 78]. ЕОК IIa B (УУР C, УДД 2).
- Рутинное выполнение внутрисосудистых методов визуализации не рекомендуется [11, 60, 77 - 78]. ЕОК III C (УУР C, УДД 1).
Комментарий. Внутрисосудистое ультразвуковое исследование и оптико-когерентная томография - диагностические методы, дополняющие КАГ, свободны от некоторых ее недостатков. Позволяют изучить поверхность и внутреннюю структуру атеросклеротических бляшек, выявить тромбоз коронарных артерий, исследовать состояние сосудистой стенки вокруг бляшек. Кроме того, с помощью этих методов удается точнее визуализировать атеросклеротическую бляшку сложной конфигурации, в том числе эксцентрические стенозы, плохо поддающиеся количественной оценке при КАГ в обычных проекциях. Эти методы могут быть полезны при диагностике ОКС [11, 58, 60, 77, 78]. Особую значимость методики имеют у больных с поражением ствола ЛКА для определения выраженности стеноза, а также для оптимизации результатов ЧКВ [77, 79].
Пороговыми значениями минимальной площади просвета при внутрисосудистом ультразвуковом исследовании для выявления гемодинамической значимости стенозов, соотносящимися с ФРК < 0,8, являются: для сосудов с референсными диаметрами 2,5 - 3 мм2 - минимальная площадь просвета (MLA) < 2,4 мм2, MLA < 2,7 мм2 - при диаметре сосуда 3 - 3,5 мм и MLA < 3,6 мм2 при диаметре сосуда > 3,5 мм [78, 80].
Пороговыми значениями минимальной площади просвета ствола ЛКА при внутрисосудистом ультразвуковом исследовании для выявления гемодинамической значимости стенозов является 6,5 мм2. Меньше 6,5 мм2 - должна выполняться реваскуляризация. Все, что больше 7,5 мм2, - можно отложить реваскуляризацию. Промежуточные значения > 6,5 мм2 и < 7,5 мм2 требуют уточнения с помощью ФРК [78, 80].
2.5 Иные диагностические исследования
Стратификация риска пациентов с ИБС
- Всем пациентам с впервые установленным диагнозом ИБС, а также при ухудшении симптомов ИБС рекомендуется стратификация риска ССО [55, 81]. ЕОК I B (УУР C, УДД 4).
Комментарий. Конечной целью диагностических исследований у лиц с впервые установленным и ранее известным диагнозом ИБС является стратификация риска ССО. Она необходима для выявления группы с высоким риском ССО, в которой можно добиться улучшения симптомов заболевания и/или прогноза при проведении реваскуляризации миокарда.
- Проведение ЭхоКГ с определением глобальной систолической функции ЛЖ с определением ФВ ЛЖ и диастолической функции ЛЖ рекомендуется для стратификации риска пациентам с впервые установленным диагнозом ИБС [8]. ЕОК I C (УУР C, УДД 5).
- Рекомендуется рассмотреть возможность эхокардиографической оценки глобальной продольной деформации для определения прогноза дополнительно к измерению ФВ ЛЖ у пациентов с впервые установленным диагнозом ИБС и ФВ ЛЖ > 35% [64]. ЕОК IIb B (УУР A, УДД 1).
- Стратификация риска с использованием данных выбранного стресс-метода визуализации или МСКТА КА или альтернативной ЭКГ с физической нагрузкой рекомендуется пациентам со стабильной ИБС с умеренными клиническими симптомами [54, 55]. ЕОК I B (УУР A, УДД 2).
- Рекомендуется рассмотреть возможность стратификации риска с использованием дополнительного неинвазивного нагрузочного стресс-метода визуализации (эхокардиография с физической нагрузкой, или эхокардиография с фармакологической нагрузкой, или сцинтиграфия миокарда с функциональными пробами, или позитронно-эмиссионная томография миокарда, или однофотонная эмиссионная компьютерная томография миокарда перфузионная, с функциональными пробами) у пациентов с нетяжелыми симптомами и стенозами >= 50%, по данным МСКТА КА, у которых недостаточно оснований для направления на КАГ [82]. ЕОК IIb B (УУР B, УДД 3).
- КАГ не рекомендуется использовать в качестве единственного метода для стратификации риска ССО [53, 55, 62, 81 - 83]. ЕОК III C (УУР A, УДД 2).
- Стратификация риска с помощью КАГ, дополненной измерением фракционного резерва коронарного кровотока (ФРК и/или МРК), рекомендуется симптомным пациентам с сомнительными или противоречивыми результатами неинвазивного тестирования [62]. ЕОК IIa B (УУР C, УДД 4).
- Стратификация риска с помощью КАГ, дополненной измерением фракционного резерва коронарного кровотока (ФРК и/или МРК), рекомендована симптомным пациентам, получающим оптимальную медикаментозную терапию, у которых неинвазивная стратификация риска показывает высокий риск ССО, и для улучшения прогноза решено проводить реваскуляризацию миокарда [56, 57]. ЕОК I A (УУР A, УДД 1).
- Стратификация риска с помощью КАГ, дополненной измерением фракционного резерва коронарного кровотока (ФРК и/или МРК), рекомендована пациентам с клиническим профилем высокого риска, особенно если симптомы плохо поддаются медикаментозной коррекции и решено проводить реваскуляризацию миокарда [56, 57]. ЕОК I A (УУР A, УДД 1).
Комментарий. Стратификация риска необходима для выявления группы с высоким риском ССО, в которой можно добиться улучшения симптомов заболевания и/или прогноза при проведении реваскуляризации миокарда. Выбор метода или группы методов, на основании которых проводится стратификация риска, зависит от ПТВ ИБС и результатов первичного обследования. В группе больных с низким и умеренным клиническим риском стратификация риска проводится по мере выполнения дополнительных специфических неинвазивных диагностических тестов и инвазивной диагностики. В группе больных с исходно высоким клиническим риском ССО стратификация риска выполняется сразу на этапе инвазивного теста. Пациенты, которые на основании неинвазивных и/или инвазивных тестов определяются как пациенты высокого риска ССО, при отсутствии противопоказаний должны быть направлены на реваскуляризацию миокарда. Суммированные критерии риска ССО для различных методов представлены в таблице ПБ1-4, приложение Б1.
3. Лечение
3.1 Консервативное лечение
3.1.1 Модификация факторов риска
Основой консервативного лечения стабильной ИБС являются устранение модифицируемых факторов риска и комплексная медикаментозная терапия. Как правило, их проводят неопределенно долго. В ходе сбора анамнеза и обследования особое внимание обращают на выявление сопутствующих АГ, СД, дислипопротеидемии [8 - 11]. Крайне важным представляется информирование пациентов о наличии у них ИБС, характере ее течения, факторах риска и стратегии лечения [21].
Комментарий. Информирование и обучение - необходимый компонент лечения, поскольку правильно информированный и обученный больной более тщательно выполняет врачебные рекомендации и может самостоятельно принимать важные решения в зависимости от симптомов заболевания. Рекомендуется обсудить с пациентом перспективы как медикаментозного, так и хирургического лечения выявленной у него формы ИБС, а также оговорить необходимость и периодичность дальнейших инструментальных и лабораторных исследований. Рекомендуется рассказать о самых типичных симптомах нестабильной стенокардии, острого инфаркта миокарда и подчеркнуть важность своевременного обращения за помощью при их появлении. Рекомендуется дать больному конкретные советы по здоровому образу жизни и важности правильного лечения сопутствующих заболеваний.
Модифицируемые факторы риска ССО: избыточная масса тела, курение, АГ, СД, дислипопротеидемия. Немодифицируемые факторы риска ССО: возраст, мужской пол, отягощенный семейный анамнез.
- При выявлении избыточной массы тела рекомендуется ее снижение с помощью дозированных физических нагрузок и низкокалорийной диеты. При необходимости рекомендуется направить пациента к врачу-диетологу для коррекции диеты и/или подбора медикаментозного лечения ожирения [21]. ЕОК I C (УУР C, УДД 5).
- Всем пациентам со стабильной ИБС рекомендуется соблюдение специальной диеты и регулярный контроль массы тела [21]. ЕОК I C (УУР C, УДД 5).
Комментарии. Основная цель диетотерапии при стабильной ИБС - снижение избыточной массы тела (нормальный ИМТ - 18.5 - 24.9 кг/м2) и уровня общего холестерина (ОХС) крови. Основные требования к диете: 1) энергетическая ценность до 2000 ккал/сут; 2) содержание ОХС до 300 мг/сут; 3) обеспечение за счет жиров не более 30% энергетической ценности пищи. Строгой диетой можно добиться снижения уровня ОХС плазмы на 10 - 15%. Снижение избыточной массы тела снижает риск общей и сердечно-сосудистой смерти. Целесообразно рекомендовать увеличивать в пищевом рационе содержание свежих фруктов и овощей (более 200 - 300 г в сутки), пищевых волокон, цельных зерен, уменьшение употребления сладкого и сладких газированных напитков. Следует ограничивать употребление жирных сортов мяса, вообще красного мяса и гастрономических продуктов. Целесообразно рекомендовать употребление рыбы 2 раза в неделю. Пациентам, особенно с сопутствующей АГ, следует ограничивать употребление поваренной соли до 5 г в сутки. Употребление 1 - 2 порций алкоголя в сутки безопасно для пациентов с ИБС. Наиболее приемлемым типом нагрузки являются ходьба, прогулки, плавание. Физическая нагрузка оказывает многочисленные положительные эффекты на факторы риска и физиологические процессы в сердечно-сосудистой системе - это тренирующий эффект с увеличением толерантности к физической нагрузке, повышение уровня холестерина липопротеидов высокой плотности, снижение массы тела, уменьшение психологического стресса, положительные эмоции, особенно при занятиях в группах. Увеличение пикового потребления кислорода на 1 мл/кг/мин сопровождается снижением риска сердечно-сосудистых заболеваний на 14 - 17% и смерти от всех причин. Малоподвижный образ жизни, напротив, влияет на больного ИБС неблагоприятно.
- Курящим пациентам настоятельно рекомендуется отказ от курения при помощи не только изменения поведенческой стратегии, но также использования фармакологической поддержки; избегать пассивного курения [21]. ЕОК I C (УУР C, УДД 5).
- Рекомендована ежегодная вакцинация против гриппа пациентов с ИБС, особенно у пожилых пациентов для снижения риска ССО и улучшения качества жизни [21]. ЕОК I B (УУР C, УДД 5).
- При сопутствующей АГ рекомендуется включать в состав медикаментозной терапии антигипертензивные средства для достижения целевого уровня АД < 140/90 мм рт.ст. (первичная цель), при условии хорошей переносимости и в возрасте до 65 - < 130/80 мм рт.ст. (вторичная цель), но не менее 120 и 70 мм рт.ст. [8, 84 - 86]. ЕОК I B (УУР B, УДД 1).
Комментарии. Повышенное АД - важнейший фактор риска развития атеросклероза и осложнений ИБС. Основная цель лечения больных АГ состоит в максимальном снижении риска развития фатальных и нефатальных ССО. Вопросы диагностики и лечения АГ рассматриваются в соответствующих клинических рекомендациях [8, 11, 16].
- При сопутствующем СД рекомендуется достижение целевых уровней гликемии (гликированного гемоглобина) с помощью диеты и гипогликемических синтетических и других средств. Важно при этом избегать эпизодов гипогликемии, которые ухудшают прогноз у пациентов с ИБС. При необходимости рекомендуется направлять пациента к врачу-эндокринологу для коррекции диеты и/или медикаментозного лечения [21]. ЕОК I C (УУР C, УДД 5).
Комментарий. Нарушение углеводного обмена и СД увеличивают риск ССО у мужчин в 3 раза, у женщин в 5 раз - по сравнению с лицами без диагноза СД. У этой категории больных контроль основных ФР ССЗ, включая АГ, дислипидемию, избыточный вес, низкую физическую активность, курение, должен осуществляться с особой тщательностью. Лечение пациентов при сопутствующем СД всегда должно включать в составе комплексной терапии ингибитор ангиотензинпревращающего фермента (иАПФ) или антагонист рецепторов к ангиотензину II.
Получены данные, свидетельствующие о благоприятном прогнозе на течение ИБС, в том числе у лиц, перенесших инфаркт миокарда, а также имеющих СН с низкой фракцией выброса гипогликемических синтетических и других средств, относящихся к группам ингибиторов натрийзависимого котранспортера глюкозы 2-го типа (SGLT2) и аналогов глюкагоноподобного пептида-1. Вопросы диагностики и лечения СД рассматриваются в соответствующих клинических рекомендациях.
3.1.2 Медикаментозное лечение стабильной ИБС
Основные цели медикаментозного лечения: устранение симптомов заболевания и профилактика сердечно-сосудистых осложнений.
3.1.2.1 Лечение, направленное на устранение симптомов заболевания
- Пациентам со стабильной ИБС рекомендуется назначить как минимум один препарат для устранения стенокардии/ишемии миокарда и улучшения качества жизни [12]. ЕОК I C (УУР C, УДД 5).
Комментарий. У всех пациентов с ИБС целесообразно оценивать эффективность назначенного лечения в ближайшее время (через 3 - 5 дней) и через 2 - 4 недели после начала терапии для проведения в случае необходимости ее дальнейшей коррекции.
ЕОК I C (УУР C, УДД 5).
- Для устранения непосредственно приступа стабильной стенокардии (обезболивания) рекомендуется назначить органические нитраты короткого действия (нитроглицерин)** [21].
ЕОК I B (УУР C, УДД 5).
Комментарий. Оценку эффективности терапии следует проводить по частоте приступов стенокардии в неделю, по потребности в приеме короткодействующего нитроглицерина, по расстоянию, которое проходит пациент до появления приступов стенокардии, или по его возможности подъема по лестнице. Для этого целесообразно рекомендовать пациентам ведение дневников самочувствия. В ряде случаев целесообразно проводить нагрузочный тест для оценки изменения толерантности к физической нагрузке.
Для купирования приступа стенокардии используют: нитроглицерин** в таблетках под язык, или нитроглицерин** аппликацией (распрыскиванием) спрея на слизистую полости рта, или изосорбида динитрат** в таблетках под язык, или аппликацией (распрыскиванием) спрея на слизистую полости рта. Эффект наступает через 1,5 - 2 мин после приема таблетки или ингаляции и достигает максимума через 5 - 7 мин. Если приступ не купируется в течение 15 - 20 мин, в том числе после повторного приема нитроглицерина** или изосорбида динитрата**, - возникает угроза развития ИМ.
- При стабильной стенокардии I - II ФК и ЧСС > 60 уд/мин рекомендуется назначить в качестве препарата 1-й линии бета-адреноблокатор (БАБ) или недигидропиридиновые блокаторы "медленных" кальциевых каналов (верапамил** или дилтиазем) (таблица ПБ1-5, Приложение Б1) для снижения ЧСС до значений 55 - 60 уд/мин [12].
ЕОК I A (УУР C, УДД 5).
- При стабильной стенокардии III - IV ФК рекомендуется сразу назначить комбинацию БАБ с дигидропиридиновыми блокаторами "медленных" кальциевых каналов для достижения ФК I [12].
ЕОК I C (УУР C, УДД 5)
Комментарий. Поскольку приступы стенокардии (эпизоды ишемии) возникают вследствие повышения потребности миокарда в кислороде, лечение, направленное на снижение ЧСС и АД, является патогенетически обоснованным. Бета-адреноблокаторы не только устраняют симптомы заболевания (стенокардию), оказывают антиишемическое действие и улучшают качество жизни больного, но и способны улучшить прогноз после перенесенного ИМ (в течение первого года), а также у больных с низкой фракцией выброса ЛЖ и хронической СН. Для лечения стенокардии БАБ назначают в минимальной дозе, которую при необходимости постепенно повышают до полного устранения приступов стенокардии или достижения максимально допустимой дозы. При применении БАБ наибольшее снижение потребности миокарда в кислороде и прирост коронарного кровотока достигается при ЧСС 55 - 60 уд/мин. Блокаторы "медленных" кальциевых каналов (БКК) по антиангинальной эффективности сопоставимы с БАБ. Дигидропиридиновые блокаторы "медленных" кальциевых каналов (амлодипин**, нифедипин**, фелодипин) преимущественно действуют на тонус артериол. Они снижают постнагрузку, улучшают кровоток и доставку кислорода в ишемизированной зоне сердца. Одновременно могут повышать ЧСС и снижать системное АД. Недигиропиридиновые БКК (дилтиазем и верапамил**) действуют преимущественно на миокард. Они уменьшают ЧСС, угнетают сократимость миокарда и атриовентрикулярную проводимость, оказывают антиаритмическое действие. В этом недигидропиридиновые ритмурежающие БКК схожи с БАБ. Наилучшие результаты по профилактике ишемии БКК показывают у больных с вазоспастической стенокардией. БКК также назначают в случаях, когда БАБ противопоказаны или не переносятся. Эти препараты обладают рядом преимуществ перед другими антиангинальными и антиишемическими средствами и могут применяться у более широкого круга больных с сопутствующими заболеваниями, чем БАБ. Препараты этого класса рекомендуется назначать при сочетании стабильной стенокардии с АГ [12]. У пациентов со стабильной ИБС особых групп (пожилой возраст, почечная и печеночная недостаточности) применение препаратов осуществлять в соответствии с инструкцией по безопасному использованию (при необходимости допустимо снижение дозировки).
- При недостаточной эффективности препаратов 1-й линии у пациентов со стабильной стенокардией рекомендуется добавить к лечению один из препаратов 2-й линии (органические нитраты или ивабрадин**, или триметазидин, ранолазин, или никорандил) - в зависимости от АД, ЧСС и переносимости профилактики приступов стенокардии и достижения ФК I [12].
ЕОК IIa B (УУР C, УДД 5).
- Рекомендуется назначение ивабрадина** у пациентов с синусовым ритмом, ФВ <= 35% и ЧСС покоя > 70 уд/мин при сохранении стенокардии, несмотря на прием БАБ, иАПФ и антагонистов минералокортикоидных рецепторов для снижения риска смертности [12].
ЕОК IIa B (УУР C, УДД 5).
- При наличии противопоказаний к назначению БАБ или не-ДГП-БКК (верапамил**, дилтиазем) пациентам со стабильной стенокардией рекомендуется назначить ивабрадин** при ЧСС > 80 и синусовом ритме [12]. ЕОК IIa C (УУР C, УДД 5).
ЕОК IIa C (УУР C, УДД 5).
- Не рекомендуется комбинированное назначение БАБ с не-ДГП-БКК (верапамилом**, дилтиаземом) у всех пациентов со стабильной ИБС из-за риска суммирования побочных эффектов [21].
ЕОК III C (УУР C, УДД 5).
- Не рекомендуется одновременное назначение дигидропиридиновых блокаторов "медленных" кальциевых каналов с не-ДГП-БКК (верапамилом**, дилтиаземом) у всех пациентов со стабильной ИБС из-за риска суммирования побочных эффектов [12]. ЕОК III C (УУР C, УДД 5).
- Не рекомендуется одновременное назначение не-ДГП-БКК (верапамил**, дилтиазем) с ивабрадином** у пациентов со стабильной ИБС, за исключением случаев, когда, несмотря на комбинированную терапию в максимально переносимых дозах, сохраняется ЧСС > 80 уд/мин [12].
ЕОК III C (УУР C, УДД 5)
3.1.2.2 Лечение, направленное на профилактику сердечно-сосудистых осложнений
Антиагрегантная терапия
- Для профилактики ССО всем пациентам со стабильной ИБС в качестве ингибитора агрегации тромбоцитов рекомендуется назначение ацетилсалициловой кислоты (АСК)** в дозе 75 - 100 мг в сутки [87]. ЕОК I A (УУР A, УДД 1)
Комментарий: Ацетилсалициловая кислота** (АСК) остается самым распространенным и доступным ингибитором агрегации тромбоцитов и при отсутствии противопоказаний должна быть назначена всем больным со стабильной ИБС.
- При непереносимости АСК** для профилактики ССО в качестве альтернативного ингибитора агрегации тромбоцитов пациентам со стабильной ИБС рекомендуется назначить клопидогрел** в дозе 75 мг в сутки [88]. ЕОК I B (УУР A, УДД 2)
Комментарий. Преимущества клопидогрела** 75 мг перед АСК** (325 мг в сутки), в отношении снижения риска суммарной частоты ИМ, инсульта и ССС были показаны в основном за счет пациентов с периферическим атеросклерозом и перемежающейся хромотой. Нет данных, продемонстрировавших преимущества других ингибиторов агрегации тромбоцитов (прасугрела и тикагрелора**) перед АСК** или клопидогрелом** у больных стабильной ИБС. Применение тикагрелора** можно рассмотреть в крайних случаях у пациентов, не переносящих и АСК**, и клопидогрел**. У больных, не имеющих клиники стенокардии, но имеющих поражение коронарных артерий по данным визуализирующих методов рекомендуется рассмотреть возможность назначения АСК** в дозе 75 - 100 мг в сутки с целью профилактики ССО.
- У пациентов со стабильной ИБС, имеющих высокий риск ишемических событий и не имеющих высокого риска кровотечения, рекомендуется рассмотреть возможность присоединения к АСК** второго ингибитора агрегации тромбоцитов. При этом соотношение пользы и риска продления такой терапии должно регулярно пересматриваться [89 - 92]. ЕОК IIa A (УУР A, УДД 2)
- У пациентов со стабильной ИБС, имеющих средний риск ишемических событий и не имеющих высокого риска кровотечений** рекомендуется рассмотреть возможность присоединения к АСК** второго ингибитора агрегации тромбоцитов. При этом соотношение пользы и риска продления такой терапии должно регулярно пересматриваться [89 - 92]. ЕОК IIb A (УУР B, УДД 2)
Комментарий. Под высоким ишемическим риском подразумевают наличие у пациента многососудистого поражения коронарных артерий, в сочетании с как минимум одним из признаков: сахарного диабета, требующего приема медикаментов, перенесенного ИМ, атеросклеротического поражения периферических артерий, хронической болезни почек (ХБП) с СКФ 15 - 59 мл/мин/1,73 м2.
Под средним ишемическим риском подразумевают наличие у пациента как минимум одного из признаков: многососудистое поражение коронарных артерий; сахарного диабета, требующего лечения; рецидивирующего ИМ, ЗПА, ХСН или ХБП рСКФ 15 - 59 мл/мин/1,73 м2.
Под высоким риском кровотечения понимают наличие у больного внутричерепного кровоизлияния, ишемического инсульта или другой внутричерепной патологии в анамнезе, недавнего кровотечения из ЖКТ или анемии вследствие потери крови из ЖКТ, другой патологии ЖКТ, ассоциирующейся с повышенным риском кровотечения, печеночной недостаточности, геморрагического диатеза, старческого возраста и синдрома "хрупкости", ХБП, требующая диализа или рСКФ < 15 мл/мин/1,73 м2.
Возможны следующие варианты усиления терапии АСК** вторым антитромботическим препаратом:
- У пациентов, перенесших ИМ и не имевших кровотечений в первый год двойной терапии ингибиторами агрегации тромбоцитов, рекомендуется рассмотреть возможность ее продления в виде сочетания АСК** с уменьшенной дозой тикагрелора** (60 мг 2 раза в сутки) вплоть до 36 месяцев для профилактики развития атеротромботических сердечно-сосудистых событий [92]. ЕОК IIa B (УУР B, УДД 2)
- У пациентов со стабильной ИБС, высоким риском тромботических осложнений и невысоким риском кровотечений рекомендуется рассмотреть возможность длительного использования АСК** в дозе 75 - 100 мг в сочетании с ривароксабаном** в дозе 2,5 мг 2 раза в сутки для профилактики развития атеротромботических сердечно-сосудистых событий [91]. ЕОК IIa B (УУР A, УДД 2)
Комментарий. Ривароксабан** - ингибитор фактора Xa в дозе 2,5 мг 2 раза в день (т.н. "сосудистая" доза) по сравнению с плацебо уменьшает совокупность таких событий, как ИМ, инсульт и смерть от СС причин, у стабилизированных пациентов, получавших преимущественно АСК и клопидогрел** после ОКС, при этом, несмотря на увеличение частоты кровотечений, снижал смертность от СС причин. В исследовании COMPASS тот же режим дозирования в сочетании с АСК** сравнивался с одной АСК**, а также с монотерапией ривароксабаном** в дозе 5 мг два раза в день, у пациентов со стабильной ИБС или заболеванием периферических артерий. Применение "сосудистой" дозы ривароксабана вновь продемонстрировало снижение ишемических событий, в том числе снижение ССС, при одновременном увеличении риска преимущественно не жизнеугрожающих кровотечений.
К больным с высоким риском тромботических осложнений атеросклероза в исследовании COMPASS относили лиц, перенесших ИМ или имеющих многососудистый коронарный атеросклероз в сочетании с атеросклеротическим поражением других сосудистых бассейнов, возрастом 365 лет или как минимум с двумя из следующих факторов риска: курение, сахарный диабет, нетяжелая ХСН в анамнезе, нелакунарный ишемический инсульт в анамнезе, ХБП с расчетной СКФ менее 60 мл/мин/1,73 м2.
- Рекомендуется рассмотреть возможность продления двойной терапии ингибитором агрегации тромбоцитов (АСК** 75 - 100 мг и клопидогрел** 75 мг) на более длительный срок у пациентов со стабильной ИБС, перенесших ИМ и не имевших кровотечений в течение первого года для профилактики ССО [89]. ЕОК IIa B (УУР B, УДД 2)
- Рекомендуется рассмотреть возможность продления терапии АСК** (75 - 100 мг в день) с прасугрелом в дозе 10 мг в день (5 мг при массе тела менее 60 кг или возрасте старше 75 лет) более 1 года у пациентов стабильной ИБС, перенесших ИМ и подвергнутых ЧКВ для профилактики ССО [89]. ЕОК IIa B (УУР B, УДД 2)
Терапия ингибиторами агрегации тромбоцитов после планового ЧКВ у пациентов со стабильной стенокардией и синусовым ритмом
- Пациентам со стабильной стенокардией после планового ЧКВ рекомендуется продолжить прием АСК** в дозе 75 - 100 мг в сутки для профилактики ССО [93, 94]. ЕОК I A (УУР A, УДД 2)
- Пациентам со стабильной стенокардией после планового ЧКВ к АСК** рекомендуется добавить клопидогрел** в поддерживающей дозе 75 мг в сутки (в случае приема поддерживающей дозы менее 5 дней рекомендуется добавление нагрузочной дозы клопидогрела** 600 мг) на 6 месяцев после стентирования вне зависимости от типа установленного стента для коронарных артерий***. В случае возникновения жизнеугрожающего кровотечения или его высокого риска продолжительность приема клопидогрела** может быть уменьшена до 3 месяцев, а в случае очень высокого риска кровотечения - до 1-го месяца [95]. ЕОК I A (УУР C, УДД 5)
Комментарий. В особых случаях при плановом стентировании, сопровождающемся высоким риском осложнений (неоптимальное позиционирование стента для коронарных артерий***, другие осложнения ЧКВ, повышающие риск тромбоза стента для коронарных артерий***, ЧКВ на стволе ЛКА или множественное стентирование коронарных артерий, а также при непереносимости АСК**) в качестве антиагрегантов рекомендуется рассмотреть возможность использования других ингибиторов агрегации тромбоцитов: прасугрела или тикагрелора** [96], по крайней мере, в период начальной терапии для профилактики ССО. Баланс эффективности и безопасности применения прасугрела или тикагрелора** по сравнению с клопидогрелом** после ЧКВ у больных стабильной стенокардией и высоким ишемическим риском не изучен. Возможность применения прасугрела или тикагрелора** изучалась лишь в единичных фармакодинамических исследованиях.
Терапия ингибиторами агрегации тромбоцитов у пациентов со стабильной ИБС и фибрилляцией предсердий
- В случае начала терапии антитромботическими средствами и при отсутствии противопоказаний назначение ПОАК [прямых ингибиторов тромбина (дабигатрана этексилат**) или прямых ингибиторов фактора Xa (апиксабан**, ривароксабан**)] предпочтительнее, чем назначение АВК [97 - 100]. ЕОК I A (УУР A, УДД 2)
- Пациентам со стабильной ИБС и ФП (мужчинам с суммой баллов по шкале CHA2DS2-VASc >= 2; женщинам с суммой баллов по шкале CHA2DS2-VASc >= 3) рекомендуется длительная терапия антитромботическими средствами [преимущественно ПОАК (прямые ингибиторы тромбина или прямые ингибиторы фактора Xa) или АВК при условии возможности поддержания МНО в пределах TTR (target therapeutic range) > 70%] для профилактики ТЭО [101]. ЕОК I A (УУР C, УДД 5)
- Пациентам со стабильной ИБС и ФП (мужчинам с суммой баллов по шкале CHA2DS2-VASc >= 1; женщинам с суммой баллов по шкале CHA2DS2-VASc >= 2) рекомендуется рассмотреть необходимость длительной терапии антитромботическими средствами [преимущественно ПОАК (прямые ингибиторы тромбина или прямые ингибиторы фактора Xa) или АВК при условии возможности поддержания МНО в пределах TTR (target therapeutic range) > 70%] для профилактики ТЭО [101]. ЕОК IIa B (УУР C, УДД 5)
Комментарий. Всем пациентам с фибрилляцией предсердий, не связанной с поражением клапанов сердца, рекомендовано использовать шкалу CHA2DS2-VASc (таблица ПБ1-6, Приложение Б1) для оценки риска тромбоэмболических осложнений (ТЭО): ишемического инсульта и системных тромбоэмболий.
Для оценки риска кровотечений предложено использовать несколько шкал, наибольшее распространение имеет шкала HAS-BLED (таблица ПБ1-7, Приложение Б1). Сумма баллов по шкале HAS-BLED >= 3 указывает на высокий риск кровотечений. Тем не менее расчетный высокий риск кровотечений не должен являться единственным ограничением к назначению антикоагулянтов. В первую очередь необходимо провести обследование больного, направленное на выявление потенциальных источников кровотечений, и скорректировать модифицируемые факторы риска, а при наличии немодифицируемых факторов выбрать наиболее безопасный антикоагулянт. Таблица ПБ1-8, содержащая модифицируемые и немодифицируемые факторы риска кровотечений, представлена в Приложении Б1.
- У пациентов со стабильной ИБС и ФП и с ИМ в анамнезе и высоким риском повторных ишемических событий, не имеющих повышенного риска жизнеугрожающих кровотечений, рекомендуется рассмотреть возможность присоединения к антитромботическому средству для перорального приема АСК** в суточной дозе 75 - 100 мг или клопидогрела** в суточной дозе 75 мг с целью профилактики ССО [91, 101, 102]. ЕОК IIb B (УУР A, УДД 2)
Комментарий. Под высоким риском кровотечения понимают наличие у больного внутричерепного кровоизлияния, ишемического инсульта или другой внутричерепной патологии в анамнезе, недавнего кровотечения из ЖКТ или анемии вследствие потери крови из ЖКТ, другой патологии ЖКТ, ассоциирующейся с повышенным риском кровотечения, печеночной недостаточности, геморрагического диатеза, старческого возраста и синдрома "хрупкости", ХБП, требующая диализа или рСКФ < 15 мл/мин/1,73 м2.
Антитромботическая терапия после планового ЧКВ у пациентов со стабильной ИБС и фибрилляцией предсердий или иными показаниями для приема антитромботических средств
- АСК** и клопидогрел** рекомендовано назначать всем пациентам во время ЧКВ (или после проведения КАГ, когда возможность проведения ЧКВ очевидна) для профилактики раннего тромбоза стентов для коронарных артерий*** [97 - 100]. ЕОК I C (УУР A, УДД 2)
- Всем пациентам с ФП при отсутствии противопоказаний рекомендуется назначать не АВК, а ПОАК (прямые ингибиторы фактора Xa - апиксабан** в дозе 5 мг x 2 раза в сутки, ривароксабан** в дозе 20 мг 1 раз в сутки или прямые ингибиторы тромбина - дабигатрана этаксилат** в дозе 150 мг x 2 раза в сутки) для длительной профилактики тромбэмболических осложнений, включая инсульт [97 - 100]. ЕОК I A (УУР A, УДД 2)
Комментарий. Дозу для каждого ПОАК следует выбирать в соответствии с показаниями при ФП.
- В случае если у больного имеется высокий риск кровотечения, преобладающий над риском тромбоза стента для коронарных артерий*** и риском инсульта, рекомендуется предпочесть возможность использования ривароксабана** в дозе 15 мг в день [99] или дабигатрана этаксилата** в дозе 110 мг x 2 раза в день [98] другим антикоагулянтам. ЕОК IIa B (УУР B, УДД 2)
Комментарий. Под высоким риском кровотечения понимают наличие у больного внутричерепного кровоизлияния, ишемического инсульта или другой внутричерепной патологии в анамнезе, недавнего кровотечения из ЖКТ или анемии вследствие потери крови из ЖКТ, другой патологии ЖКТ, ассоциирующейся с повышенным риском кровотечения, печеночной недостаточности, геморрагического диатеза, старческого возраста и синдрома "хрупкости", ХБП, требующая диализа или рСКФ < 15 мл/мин/1,73 м2.
Под риском тромбоза стента для коронарных артерий*** подразумевают риск самого тромбоза и риск смерти от тромбоза. Эти риски определяются нижеперечисленными анатомическими, процедурными и клиническими факторами: ЧКВ на стволе ЛКА или проксимальном отделе ПНА, ЧКВ на последней функционирующей коронарной артерии, неоптимальное позиционирование стента для коронарных артерий***, установка стентов для коронарных артерий*** длиной более 60 мм, бифуркационное стентирование с имплантацией двух стентов для коронарных артерий***, лечение хронических окклюзий, тромбоз стента для коронарных артерий*** в анамнезе, возникший вопреки адекватной антитромботической терапии, сахарный диабет, ХБП.
Риск инсульта определяется для каждого больного в соответствии с количеством баллов, набранных по шкале CHA2DS2-VASc (Приложение Б1, таблица ПБ1-6).
- В случае неосложненного ЧКВ (вне зависимости от типа установленного стента для коронарных артерий***) при условии низкого риска тромбоза стента или при риске кровотечения, превышающем риск тромбоза стента для коронарных артерий***, рекомендуется рассмотреть возможность ограничения длительности терапии АСК** в составе тройной антитромботической терапии (АСК** + клопидогрел** + антагонист витамина K) одной неделей [97]. ЕОК IIa B (УУР B, УДД 2)
- В случае преобладания риска тромбоза стента для коронарных артерий*** над риском кровотечения рекомендуется рассмотреть возможность продления тройной антитромботической терапии (АСК** + клопидогрел** + антагонист витамина K) до 1 - 6 месяцев [103]. ЕОК IIa C (УУР B УДД 2)
Комментарий: Мнение об оптимальной длительности тройной антитромботической терапии (ТАТ) после планового ЧКВ у больного ФП претерпело ряд существенных изменений за последние годы и продолжает оставаться предметом дискуссий. По общему мнению экспертов, изложенному в коллегиальном документе 2018 г., длительность ТАТ может быть от 1 до 6 месяцев, а минимальный срок может быть ограничен периодом госпитализации с назначением двойной антитромботической терапии (комбинация полной дозы ПОАК и клопидогрела**) сразу после выписки больного из стационара. Факторами, способствующими удлинению назначения тройной антитромботической терапии, являются использование стентов для коронарных артерий, выделяющих лекарственное средство***, 1-го поколения и наличие факторов риска тромботических осложнений (таких, как стентирование ствола левой коронарной артерии или проксимального сегмента передней нисходящей артерии, бифуркационное стентирование, инфаркт миокарда или тромбоз стента для коронарных артерий*** в анамнезе, высокий балл по шкале SYNTAX). В пользу сокращения сроков антитромботической терапии указывают наличие высокого риска кровотечений и низкий атеротромботический риск (определенный, в том числе с использованием шкал REACH или SYNTAX). Необходимая длительность многокомпонентной антитромботической терапии должна быть четко обозначена в выписном эпикризе пациента. Алгоритм назначения многокомпонентной терапии у больного ФП после планового ЧКВ указан на рисунке ПБ1 в Приложении Б1.
- У пациентов с показаниями к назначению АВК в комбинации с АСК** и/или клопидогрелом** рекомендуется поддерживать целевое МНО в диапазоне от 2,0 до 2,5, а показатель TTR более 70% [97 - 99]. ЕОК IIa B (УУР B, УДД 2)
- У пациентов с умеренным или высоким риском тромбоза стента для коронарных артерий*** (независимо от типа установленного стента для коронарных артерий***) в качестве альтернативы тройной антитромботической терапии АСК**, клопидогрелом** и антагонистом витамина K для перорального приема рекомендуется иметь в виду возможность двойной терапии антитромботическим средством и тикагрелором**/прасугрелом [98]. ЕОК IIb C (УУР B, УДД 2)
Комментарий. Применение тикагрелора** и прасугрела как препаратов, обладающих более мощным антитромбоцитарным действием и потенциально более опасных в отношении риска кровотечений, чем клопидогрел**, в составе тройной антитромботической терапии не рекомендуется.
Под риском тромбоза стента для коронарных артерий*** подразумевают риск самого тромбоза и риск смерти от тромбоза. Эти риски определяются нижеперечисленными анатомическими, процедурными и клиническими факторами: ЧКВ на стволе ЛКА или проксимальном отделе ПНА, ЧКВ на последней функционирующей коронарной артерии, неоптимальное позиционирование стента для коронарных артерий***, установка стентов для коронарных артерий*** длиной более 60 мм, бифуркационное стентирование с имплантацией двух стентов для коронарных артерий***, лечение хронических окклюзий, тромбоз стента для коронарных артерий*** в анамнезе, возникший вопреки адекватной антитромботической терапии, сахарный диабет, ХБП.
- У пациентов со стабильной ИБС с высоким риском кровотечений из ЖКТ или при наличии кровотечения ЖКТ в анамнезе, получающих АСК** или комбинацию нескольких антитромботических средств, для защиты слизистой желудка и профилактики желудочно-кишечных кровотечений рекомендуется использовать ингибиторы протоновой помпы (по показанию - профилактика эрозивно-язвенных поражений желудка и двенадцатиперстной кишки, связанных с приемом нестероидных противовоспалительных препаратов) [104 - 108]. ЕОК I A (УУР A, УДД 2)
Комментарий. Применение ингибиторов протоновой помпы рекомендуется всем пациентам, получающим тройную антитромботическую терапию, а также у пациентов с повышенным риском желудочно-кишечных кровотечений (язвенная болезнь или желудочно-кишечное кровотечение в анамнезе, хроническое использование нестероидных противовоспалительных средств или кортикостероидов, как минимум 2 из следующих признаков - возраст 365 лет, диспепсия, желудочно-пищеводный рефлюкс, инфицирование Helicobacter Pylory, хроническое употребление алкоголя) (по показанию профилактика эрозивно-язвенных поражений желудка и двенадцатиперстной кишки, связанных с приемом нестероидных противовоспалительных препаратов). Возможность ослабления антитромбоцитарного эффекта клопидогрела** продемонстрирована при его сочетании с омепразолом** или эзомепразолом**, но не с пантопразолом или рабепразолом. Нет доказательств, что эти лекарственные взаимодействия оказывают неблагоприятное влияние на клинические результаты лечения.
Гиполипидемическая терапия
- Все пациенты с хронической ИБС относятся к категории лиц очень высокого риска, поэтому для профилактики ССО им всем рекомендуется коррекция дислипидемии с использованием мероприятий по здоровому образу жизни и оптимальной медикаментозной терапии [21, 24] для профилактики ССО.
ЕОК I A (УУР C, УДД 5).
- Для профилактики ССО всем пациентам со стабильной ИБС рекомендуется назначить ингибиторы ГМГ-КоА-редуктазы (статины) в максимально переносимой дозировке до достижения целевого уровня ХсЛНП (< 1,4 ммоль/л) и его снижения на 50% от исходного уровня [109].
ЕОК I A (УУР C, УДД 5).
- Для пациентов с ИБС, перенесших в течение 2 лет на фоне липидснижающей терапии повторное сердечно-сосудистое событие рекомендуется рассмотреть возможность комбинированной липидснижающей терапии для достижения целевого уровня ХсЛНП < 1,0 ммоль/л [109].
ЕОК IIb B (УУР C, УДД 5).
- При невозможности достижения у пациентов со стабильной ИБС целевого уровня ХсЛНП (< 1,4 ммоль/л) и его снижения на 50% от исходного уровня на фоне максимальных переносимых доз ингибиторов ГМГ-КоА-редуктазы, или у пациентов с непереносимостью ингибиторов ГМГ-КоА-редуктазы, рекомендуется к лечению добавить эзетимиб для профилактики ССО [109]. ЕОК I B (УУР C, УДД 5).
- У пациентов со стабильной ИБС при невозможности достижения целевого уровня ХсЛНП, несмотря на применение максимальной переносимой дозы ингибиторов ГМГ-КоА-редуктазы в комбинации с эзетимибом, или у пациентов с непереносимостью ингибиторов ГМГ-КоА-редуктазы, рекомендуется назначить один из ингибиторов пропротеиновой конвертазы субтилизин-кексинового 9-го типа (PCSK9) (в соответствии с АТХ-классификацией другие гиполипидемические средства, C10AX) (алирокумаб** или эволокумаб**) для профилактики ССО [109 - 111].
ЕОК IIa A (УУР A, УДД 2).
Комментарий. При всех формах ИБС терапию ингибиторами ГМГ-КоА-редуктазы нужно начинать сразу после установления диагноза, независимо от уровней общего холестерина (ОХС) и ХсЛНП (в отсутствие прямых противопоказаний). Эффективность терапии оценивается по уровню ХсЛНП: оптимальный уровень этого показателя должен быть < 1,4 ммоль/л и снижен на 50% от исходного уровня. Доказано, что снижение уровней ОХС и ХсЛНП в крови сопровождается снижением общей смертности в популяции и риска всех ССО приблизительно на 20%. Липидснижающая терапия при хронической ИБС проводится, при отсутствии побочных эффектов, неопределенно долго [109]. Широкое применение ингибиторов PCSK9 ограничено нерешенным вопросом финансирования такой терапии из-за ее стоимости.
- У пациентов со стабильной ИБС при сопутствующих заболеваниях, имеющих существенное значение для прогноза (постинфарктный кардиосклероз, АГ, СД, СН), для профилактики ССО рекомендуется назначать иАПФ или АРА [21].
ЕОК I A (УУР C, УДД 5).
Комментарий. Ингибиторы АПФ снижают общую смертность, риск развития ИМ, инсульта и прогрессирования СН у пациентов, перенесших ИМ, а также при сопутствующем СД. Назначение иАПФ лицам со стабильный ИБС особенно показано при наличии АГ, ХСН при ФВ ЛЖ <= 40%, хронических заболеваний почек с начальной и умеренной азотемией. Препараты для назначения при наличии ИБС: периндоприл**, рамиприл. При непереносимости иАПФ, по тем же показаниям, в качестве альтернативы назначают антагонисты рецепторов к ангиотензину II. Препараты при наличии ИБС и ХСН: лозартан**, валсартан**, кандесартан [21].
- Рекомендуется рассмотреть возможность назначения спиронолактона** (25 мг/сут) или эплеренона у пациентов, перенесших ИМ, которые уже получают терапевтические дозы ингибитора АПФ и бета-адреноблокатора, имеют ФВ ЛЖ <= 35%, а также СД или СН для профилактики сердечно-сосудистой смерти [112, 113]. Следует соблюдать осторожность при применении альдостерона антагонистов у пациентов с нарушением функции почек [расчетная СКФ < 45 мл/мин/1,73 м2] и у пациентов с уровнем калия в сыворотке крови > 5,0 ммоль/л [114].
ЕОК IIb B (УУР B, УДД 2).
3.1.3 Медикаментозное лечение особых форм стабильной ИБС
Лечение микрососудистой стенокардии должно быть направлено на главный механизм ее возникновения - микрососудистую дисфункцию.
- Пациентам с аномальным резервом коронарного кровотока (РКК) < 2,0 или индексом микроциркуляторной резистивности >= 25 ед с негативным ацетилхолин-провокационным тестом рекомендуется назначение БАБ, органических нитратов, БКК, иАПФ, изменение образа жизни, коррекция веса [115, 116]. ЕОК I A (УУР A, УДД 2).
Комментарий. При неэффективности вышеуказанных препаратов у больных микрососудистой стенокардией для профилактики приступов возможно дополнительное назначение ранолазина [117], никорандила, аминофиллина**.
- Пациентам с возникшими ЭКГ-изменениями в ответ на введение ацетилхолина хлорида (S01EB09), но без выраженной вазоконстрикции эпикардиальных КА (что подтверждает спазм микрососудов), может быть рекомендовано проведение медикаментозного лечения, как у больных с вазоспастической стенокардией для профилактики приступов стенокардии [72].
ЕОК IIb C (УУР B, УДД 2).
Комментарий. Эффективность индивидуальной стратегии лечения была продемонстрирована в исследовании CorMiCa, в котором участвовал 151 пациент со стратифицированной медикаментозной терапией (основанной на результатах РКК, индекса микроциркуляторной резистивности, теста с ацетилхолином хлоридом (S01EB09)) и группа сравнения с подбором терапии по результатам стандартной КАГ. Спустя год в группе стратифицированной терапии было продемонстрировано улучшение шкалы приступов стенокардии [117].
Вазоспастическая стенокардия
- Постановка диагноза вазоспастической стенокардии (ВСС) рекомендуется на основании выявления транзиторных ишемических изменений сегмента ST во время приступа стенокардии (регистрация электрокардиограммы в покое, расшифровка, описание и интерпретация электрокардиографических данных). Для пациентов со стенокардией Принцметалла характерны подъемы сегмента ST во время приступа [70, 118].
ЕОК I A (УУР C, УДД 5).
- В диагностике ВСС рекомендуется опираться на регистрацию спонтанных ишемических изменений (как правило, подъема сегмента ST) по данным ЭКГ в 12 отведениях во время приступа, или холтеровского мониторирования сердечного ритма в 12 отведениях с пролонгацией до 1 недели, или имплантированного петлевого регистратора для долговременной регистрации электрической активности проводящей системы сердца. Рекомендуется проводить холтеровское мониторирование сердечного ритма всем пациентам с ВСС с целью оценки эффективности медикаментозной терапии [70, 118].
ЕОК I A (УУР C, УДД 5).
- Пациентам с вероятной ВСС рекомендуется проведение КАГ с целью исключения возможных стенозов КА. Ангиографическое подтверждение вазоспазма может потребовать проведения фармакологического тестирования в катетеризационной лаборатории [70, 118].
ЕОК I A (УУР C, УДД 4).
Комментарий. Провокация коронарного спазма считается положительной в случае провокации: а) ангинозного приступа, б) ишемических изменений на ЭКГ, в) выраженной вазоконстрикции эпикардиальных артерий. В случае отсутствия всех трех событий тест следует считать сомнительным. Развитие приступа стенокардии в ответ на введение ацетилхолина хлорида (S01EB09) в отсутствие ангиографически документированного вазоспазма с /или без сопутствующих изменений на ЭКГ может указывать на наличие микрососудистой стенокардии. В этих случаях целесообразно для верификации ишемии миокарда дополнить тест с ацетилхолином хлоридом (S01EB09) введением в/в радиофармпрепарата Tc99 с последующим проведением ОФЭКТ миокарда [119].
- Для пациентов с вазомоторными нарушениями эпикардиальных или микрососудов коронарного русла БКК или пролонгированные органические нитраты рекомендуются как препараты выбора для профилактики приступов стенокардии в дополнение к модификации факторов риска атеросклероза и образа жизни [71].
ЕОК I A (УУР C, УДД 5).
Комментарий. Нифедипин** продемонстрировал также эффективность в купировании спазма КА, ассоциированного со стентированием КА [120].
У пациентов со стабильной ИБС особых групп (пожилой возраст, почечная и печеночная недостаточности) применение препаратов осуществлять в соответствии с инструкцией по безопасному использованию (при необходимости допустимо снижение дозировки).
3.2 Хирургическое лечение (реваскуляризация миокарда)
Решение о выборе метода лечения принимается рентгенэндоваскулярным хирургом, сердечно-сосудистым хирургом и врачом-кардиологом по результатам КАГ, данных неинвазивных и инвазивных методов обследования и анализа клинических данных. В случае отсутствия в клинике сердечно-сосудистого хирурга, при поражении ствола ЛКА с баллом по шкале SYNTAX > 32 и при многососудистом поражении с баллом по шкале SYNTAX > 23 целесообразно использовать возможности телемедицинских консультаций.
3.2.1 Реваскуляризация у пациентов со стабильной стенокардией и безболевой ишемией миокарда
- Для улучшения прогноза рекомендуется проводить реваскуляризацию при:
- поражении ствола ЛКА > 50%,
- проксимальном стенозе ПНА > 50%,
- двух и трехсосудистом поражении со стенозами > 50% и сниженной фракцией выброса ЛЖ (ФВ ЛЖ <= 35%),
- большой площади преходящей ишемии миокарда при нагрузочном стресс-тестировании (> 10% площади ЛЖ) или значимом ФРК, либо при стенозе > 50% в единственной сохранной коронарной артерии (при наличии задокументированной ишемии миокарда; или ФРК < 0,80, МРК < 0,89; или стенозе > 90%) [38, 54, 56, 121 - 144]. ЕОК I B (УУР B, УДД 1)
Комментарий. Вмешательство на коронарных артериях улучшает прогноз пациентов с выявленной большой зоной стресс-индуцированной ишемии миокарда. О большой зоне ишемии миокарда также можно судить по наличию гемодинамически значимого поражения крупной коронарной артерии: ствола ЛКА, проксимального отдела передней нисходящей артерии, двух- или трехсосудистого поражения со снижением функции левого желудочка, единственного сохранившегося коронарного сосуда.
- Для уменьшения выраженности симптомов ишемии рекомендуется проводить реваскуляризацию при гемодинамически значимом стенозировании КА (по данным нагрузочных стресс-тестов и/или измерения фракционного резерва коронарного кровотока) при наличии ограничивающей физическую активность стенокардии или ее эквивалентах, несмотря на оптимальную медикаментозную терапию [56, 135 - 152]. ЕОК I B (УУР B, УДД 1)
Комментарии. ЧКВ показано пациентам с ИБС при сохранении симптомов стенокардии несмотря на проводимое оптимальное медикаментозное лечение при наличии гемодинамически значимых поражений коронарных артерий. Альтернативным способом определения значимости стеноза является измерение ФРК во время диагностической коронарографии [62, 153]. Отказ от вмешательства на стенозах с ФРК >= 0,80 в пользу только медикаментозной терапии показал свою обоснованность в клинических исследованиях [151, 153]. Следует отметить, что для стенозов коронарных артерий менее 90% необходимы дополнительные тесты для доказательства их гемодинамической значимости (таких как документированная ишемия миокарда, в т.ч. по данным нагрузочных проб с визуализацией миокарда, или определение ФРК) [130].
- ЧКВ стенозов (более 70%) проксимальных сегментов коронарных артерий должно быть рассмотрено у пациентов, которым планируется транскатетерная имплантация аортального клапана [73, 154, 155]. IIa C (УУР C, УДД 4)
3.2.2 Реваскуляризация миокарда у больных с вазоспастической стенокардией
- При вазоспастической стенокардии реваскуляризация миокарда не рекомендуется (ЧКВ или КШ) [156 - 161]. ЕОК III C (УУР B, УДД 3)
3.2.3 Выбор метода реваскуляризации миокарда
Для плановой реваскуляризации миокарда при стабильной ИБС проводят ЧКВ со стентированием КА (транслюминальная баллонная ангиопластика и стентирование коронарных артерий, или стентирование коронарной артерии) либо операцию КШ (коронарное шунтирование в условиях искусственного кровообращения или коронарное шунтирование на работающем сердце без использования искусственного кровообращения).
- Для выбора наиболее эффективного метода реваскуляризации миокарда с целью минимизации рисков неблагоприятных сердечно-сосудистых событий рекомендуется учитывать: анатомические особенности поражения коронарных артерий; сопутствующую патологию и вероятные риски вмешательства; согласие пациента на конкретный способ оперативного вмешательства [38, 54, 56, 121, 128, 129, 131, 140, 146]. ЕОК I A (УУР A, УДД 1)
Комментарии. В случае, когда технически возможно проведение и КШ, и ЧКВ при согласии пациента на любой тип оперативного лечения, выбор метода зависит в основном от анатомических особенностей поражения коронарного русла (число и характер поражений, вовлеченность бифуркаций и устьев, протяженность, извитость и кальциноз коронарных артерий).
В таблице ПБ1-9 Приложения Б1 представлены эндоваскулярный и хирургический методы реваскуляризации миокарда в зависимости от вовлеченности коронарного русла с указанием уровней убедительности, достоверности и источников литературы [162 - 180]. При поражении ствола ЛКА или при многососудистом поражении для принятия решения о методе вмешательства на коронарных артериях необходим подсчет баллов по шкале SYNTAX, который впервые был применен в одноименном исследовании для стратификации риска и определения прогноза пациентов при разных способах оперативного лечения. КШ имеет преимущество перед ЧКВ при поражении ствола ЛКА с баллом по шкале SYNTAX > 32 и при многососудистом поражении с баллом по шкале SYNTAX > 23.
3.2.4 Выбор типа стена при ЧКВ
В настоящее время существуют два типа стентов для коронарных артерий***, применяющихся при ЧКВ у пациентов с ИБС: стент для коронарных артерий, выделяющий лекарственное средство*** (СКАВЛС) и стенты для коронарных артерий металлические непокрытые***.
- Всем пациентам со стабильной ИБС при реваскуляризации миокарда методом ЧКВ рекомендуется применение стентов для коронарных артерий, выделяющих лекарственное средство***, вне зависимости от клинической картины заболевания, типа атеросклеротической бляшки, ожидаемой плановой операции, продолжительности двойной антитромбоцитарной терапии и сопутствующей антикоагулянтной терапии [181 - 183]. ЕОК I A (УУР A, УДД 1)
Комментарий. В зависимости от дизайна стента для коронарных артерий*** и лекарственного покрытия, выделяют более ранние и новые поколения стентов для коронарных артерий, выделяющих лекарственное средство***. Как правило, к раннему поколению СКАВЛС*** относятся стенты для коронарных артерий***, покрытые сиролимусом или паклитакселем, к новому - эверолимусом, зотаролимусом и биолимусом A9. Дальнейшее развитие технологии производства стентов для коронарных артерий*** и внедрение в клиническую практику СКАВЛС*** нового (не первого) поколения связано с использованием новых антипролиферативных агентов (эверолимус, зотаролимус, биолимус A9), новых металлических сплавов (кобальт-хром, платина-хром и др.) и платформ стентов для коронарных артерий***, а также новых полимеров и схем их нанесения. Благодаря применению новых технологий, СКАВЛС*** нового поколения, в отличие от СКАВЛС*** раннего поколения, имеют меньший профиль, большую гибкость и надежность фиксации стента для коронарных артерий*** к системе доставки, демонстрируя лучшие показатели доставляемости к месту поражения в коронарном русле. СКАВЛС*** нового поколения имеют бесспорное преимущество при сложных коронарных вмешательствах, таких как выраженная извитость и кальциноз коронарных артерий, малый диаметр артерий (менее 2,5 мм), протяженное поражение (более 20 мм), бифуркационные поражения, стенозы ствола ЛКА, хронические тотальные окклюзии коронарных артерий, а также при рестенозах. Результаты крупных регистров, многоцентровых рандомизированных клинических исследований последних лет, а также данные метаанализов продемонстрировали, что применение СКАВЛС*** нового поколения при ЧКВ у пациентов с ИБС ассоциировано со значительно меньшей частотой неблагоприятных сердечно-сосудистых событий по сравнению со стентами для коронарных артерий металлическими непокрытыми***: частота рестеноза снизилась в 5 раз, риск повторной реваскуляризации снизился в 4 раза, риск тромбозов стента для коронарных артерий*** снизился в 2 раза (преимущественно использовались стенты для коронарных артерий, выделяющие лекарственное средство***, покрытые эверолимусом, зотаролимусом). Таким образом, стенты для коронарных артерий, выделяющие лекарственное средство***, должны применяться у всех пациентов с ИБС [184 - 187].
3.2.5 Выбор сосудистого доступа
- Использование радиального доступа рекомендуется для ЧКВ у всех пациентов с ИБС, кроме случаев, когда вмешательство требует другого доступа (малый диаметр лучевых артерий, окклюзии и извитость артерий верхних конечностей, использование инструментов больших диаметров (более 7 Френч), при высокой вероятности КШ (например, известное поражение КА, неподходящее для ЧКВ) [188 - 190]. ЕОК I A (УУР A, УДД 1)
Комментарий. Использование радиального доступа является предпочтительным, поскольку снижает смертность и количество серьезных сердечно-сосудистых осложнений, а также увеличивает безопасность ЧКВ за счет снижения риска больших кровотечений и других сосудистых осложнений независимо от формы ИБС.
3.2.6 Тактика операций коронарного шунтирования
Комментарий. При множественном гемодинамически значимом атеросклерозе коронарных артерий в большинстве случаев проводится операция КШ с искусственным кровообращением или без него. Кальциноз восходящей аорты, удобное для операции и неосложненное поражение коронарных артерий предполагает более эффективное в этих случаях коронарное шунтирование без искусственного кровообращения.
- В качестве шунтов у всех пациентов рекомендуется использование левой внутренней грудной артерии для увеличения времени "выживаемости" шунта. При отсутствии высокого риска стернальных осложнений (ожирения, декомпенсированного сахарного диабета) рекомендуется использование правой внутренней грудной артерии. В дополнение к внутренним грудным артериям при стенозах коронарных сосудов более 80% и/или их окклюзиях рекомендовано применение лучевой артерии в качестве аортокоронарных шунтов, реваскуляризация остальных ветвей проводится аутовенозными трансплантатами [191 - 196]. ЕОК I B (УУР B, УДД 2)
Комментарий. Операции коронарного шунтирования с искусственным кровообращением обеспечивают полную реваскуляризацию миокарда, и в большинстве наблюдений отдаленные результаты лучше, чем без искусственного кровообращения. Широкое применение аутоартериальных трансплантатов обеспечивает лучшую отдаленную проходимость шунтов и снижение количества рецидивов стенокардии [191 - 196].
3.3 Лечение рефрактерной стенокардии
К рефрактерной относят стенокардию, симптомы которой длятся более 3-х месяцев, при этом верифицирована преходящая ишемия миокарда, имеется тяжелое поражение коронарного русла, и эти симптомы не удается контролировать путем усиления медикаментозной терапии за счет добавления препаратов второй и третьей линии, коронарного шунтирования или стентирования, включая ЧКВ хронической полной коронарной окклюзии [12].
- В ряде случаев у пациентов с рефрактерной к оптимальной медикаментозной терапии и реваскуляризирующим вмешательствам стенокардией, с учетом низкого качества их жизни - для облегчения симптомов, рекомендуется рассмотреть возможность таких видов лечения, как:
- Контрпульсация наружная [197] ЕОК IIb B (УУР A, УДД 2).
- Эпидуральная спинномозговая электростимуляция (имплантация системы электростимуляции периферических нервов) [198]. ЕОК IIb B (УУР A, УДД 2).
Комментарий. Терапия стволовыми клетками у больных с рефрактерной стенокардией в настоящее время рассматривается лишь как потенциально возможная. Тем не менее, следует отметить, что совокупный анализ на уровне пациентов (n = 304), включенных в три двойных слепых плацебо-контролируемых исследования клеточной терапии, среди которых было и исследование RENEW (Эффективность и безопасность внутримиокардиального введения аутологичных CD34 + клеток у пациентов с рефрактерной стенокардией), продемонстрировали, что активное лечение при помощи аутологичных гемопоэтических клеток увеличивает ТФН и уменьшает частоту приступов стенокардии [199].
- Экстракорпоральная кардиологическая ударно-волновая терапия не рекомендуется при стабильной ИБС [12]. ЕОК III C (УУР C, УДД 5).
- Трансмиокардиальная реваскуляризация не рекомендуется при стабильной ИБС [200]. ЕОК III A (УУР B, УДД 2).
4. Реабилитация
- Трудоспособных пациентов с впервые установленным диагнозом стабильной ИБС, чья профессиональная деятельность связана с тяжелым физическим трудом и потенциальным общественным риском (летчики, крановщики, водители общественного транспорта и т.п.), рекомендуется направлять на медико-социальную экспертизу для определения группы инвалидности [201 - 205]. ЕОК I C (УУР C, УДД 5).
- Пациентов со стенокардией III - IV ФК рекомендуется направлять на медико-социальную экспертизу для определения группы инвалидности [201 - 205]. ЕОК I C (УУР C, УДД 5).
Комментарии: Трудоспособность больного со стабильной ИБС зависит от ФК стенокардии и СН, сопутствующих заболеваний, характера профессии.
Пациентов со стабильной стенокардией I - II ФК без опасных нарушений сердечного ритма и проводимости можно направлять в местные кардиологические санатории, бальнеологические и климатические курорты для проведения комплексной программы реабилитации. Пациентам со стенокардией III - IV ФК и тяжелыми сопутствующими заболеваниями санаторное лечение не рекомендуется [21].
- Рекомендуется включение всех пациентов со стабильной ИБС, больных, перенесших ОКС, ЧКВ или КШ, в комплексные программы вторичной профилактики и реабилитации для повышения приверженности к лечению, изменения образа жизни и коррекции сердечно-сосудистых факторов риска [206 - 210]. ЕОК I A (УУР A, УДД 1).
Комментарий. Программа реабилитация должна осуществляться мультидисциплинарной командой и включать три этапа: стационарный - в период интенсивного наблюдения, и реабилитационный амбулаторный. Правильно построенная программа физической и психологической реабилитации, основанная на индивидуальной оценке возраста, исходном уровне активности и физических ограничений способствует повышению приверженности к медикаментозному лечению и мероприятиям по изменению образа жизни, включающим диету, регулярные физические нагрузки и отказ от курения. После определения индивидуальной переносимости физической нагрузки и оценки связанного с ней риска рекомендуется разработать программу реабилитации, включающую регулярные аэробные физические нагрузки умеренной интенсивности по 30 - 60 минут как минимум 5 дней в неделю. Больных с малоподвижным образом жизни следует активно стимулировать к началу программ физической реабилитации с нагрузками небольшой интенсивности.
Чтобы помочь больному придерживаться здорового образа жизни, обеспечить контроль сердечно-сосудистых факторов риска и надлежащую приверженность к медикаментозной терапии, рекомендуются когнитивные поведенческие вмешательства.
- Для реализации программы реабилитации пациентов с ИБС, перенесших ОКС, ЧКВ или КШ, рекомендуется сформировать мультидисциплинарную команду специалистов (врачи-кардиологи, врачи-терапевты, врачи общей практики, врачи-диетологи, врачи-физиотерапевты, медицинские психологи, медицинские сестры) [211 - 219]. ЕОК I A (УУР B, УДД 2).
5. Профилактика
- Всем пациентам со стабильной ИБС рекомендуется диспансерное наблюдение врача-терапевта для определения частоты визитов, контроля за выполнением предписанных рекомендаций, своевременного изменения терапии, оценки риска ССО, направления на дополнительные исследования, санаторно-курортное лечение и, при необходимости, - на госпитализацию [8 - 12]. ЕОК I C (УУР C, УДД 5).
- Рекомендуется диспансерное наблюдение за пациентами с неосложненными формами стабильной ИБС проводить силами врача-терапевта, врача общей практики (семейного врача) [8 - 12]. ЕОК IIa C (УУР C, УДД 5).
- Рекомендуется диспансерное наблюдение за пациентами с осложненными формами стабильной ИБС проводить силами врача-кардиолога [8 - 12]. ЕОК IIa C (УУР C, УДД 5).
- При появлении новых или обострении старых симптомов у пациентов со стабильной ИБС рекомендуется проводить консультацию врача-кардиолога [8 - 12]. ЕОК I C (УУР C, УДД 5)
- Для решения вопроса о направлении пациентов со стабильной ИБС на ЭхоКГ, нагрузочные пробы, КАГ и на другие визуализирующие исследования рекомендуется проводить консультацию врача-кардиолога [8 - 12]. ЕОК I C (УУР C, УДД 5).
- Контрольные амбулаторные осмотры пациентов со стабильной ИБС рекомендуется проводить каждые 4 - 6 месяцев на первом году лечения врачу-терапевту или врачу-кардиологу (при наличии показаний для диспансерного наблюдения) [8 - 12]. ЕОК I C (УУР C, УДД 5).
Комментарий. Во время визитов проводят тщательный сбор анамнеза, физикальное исследование и биохимические исследования крови - в зависимости от клинической картины заболевания.
Пациентам со стабильной ИБС рекомендуется:
- Регистрация электрокардиограммы в покое. Расшифровка, описание и интерпретация электрокардиографических данных 1 раз в год и дополнительно - при ухудшении течения стенокардии, появлении аритмии, а также при назначении/изменении лечения, влияющего на внутрисердечную электрическую проводимость [8 - 12]. ЕОК I C (УУР C, УДД 5).
- Мониторирование электрокардиографических данных с физической нагрузкой или любой визуализирующий ишемию стресс-метод (эхокардиография с физической нагрузкой, или эхокардиография с фармакологической нагрузкой, или сцинтиграфия миокарда с функциональными пробами или Позитронно-эмиссионная томография миокарда, или однофотонная эмиссионная компьютерная томография миокарда перфузионная, с функциональными пробами) рекомендуется проводить больным со стабильной ИБС при появлении новых или возобновлении прежних симптомов заболевания - после исключения нестабильности состояния для определения показаний к реваскуляризации миокарда [8 - 12]. ЕОК I C (УУР C, УДД 5).
- Рекомендуется врачу-терапевту рассмотреть возможность повторного мониторирования электрокардиографических данных с физической нагрузкой не ранее, чем через два года после предыдущего исследования (кроме случаев изменения симптомов заболевания) для оценки эффективности назначенной терапии и определения показаний для реваскуляризации миокарда [8 - 12]. ЕОК IIb C (УУР C, УДД 5).
- Врачу-терапевту рекомендуется проводить вторичную профилактику ССО всем пациентам со стабильной ИБС после реваскуляризации миокарда, а также запланировать их контрольный визит к врачу после выписки из стационара в течение 3 дней [8 - 12]. ЕОК I A (УУР C, УДД 5).
- Всем трудоспособным пациентам с диагнозом стабильной ИБС после реваскуляризации миокарда рекомендуется советовать возвращение к своей работе и прежнему уровню полноценной деятельности для улучшения качества жизни пациента. При возобновлении симптомов рекомендовать немедленно обращаться к врачу [8 - 12]. ЕОК I C (УУР C, УДД 5).
- После реваскуляризации миокарда всем пациентам с ИБС рекомендуется антитромботическая терапия (обычно использование АСК**) на неопределенно долгое время для профилактики ССО [8 - 12]. ЕОК I A (УУР C, УДД 5).
- Всем пациентам после планового ЧКВ с имплантацией стента для коронарных артерий металлический непокрытый*** рекомендуется двойная антитромботическая терапия в течение как минимум одного месяца для профилактики тромбоза стента для коронарных артерий*** [8 - 12]. ЕОК I A (УУР C, УДД 5).
- Всем пациентам после планового ЧКВ с имплантацией стента для коронарных артерий, выделяющего лекарственное средство***, рекомендуется двойная терапия ингибиторами агрегации тромбоцитов в течение 6 месяцев для профилактики тромбоза стента для коронарных артерий*** [8 - 12]. ЕОК I B (УУР C, УДД 5).
- Всем пациентам с ИБС при высоком риске ишемических осложнений после реваскуляризации (тромбоз стента для коронарных артерий***, рецидив ОКС, ИМ в анамнезе) и низком риске кровотечений рекомендуется рассмотреть возможность назначения двойной антитромботической терапии в течение более 12 месяцев для профилактики ССО [8 - 12]. ЕОК IIb B (УУР C, УДД 5).
- Всем пациентам с ИБС при высоком риске кровотечений, или при сопутствующей терапии антикоагулянтами, рекомендуется рассмотреть возможность назначения двойной терапии ингибиторами агрегации тромбоцитов в течение 1 - 3 месяцев после реваскуляризации миокарда для профилактики развития больших и жизнеугорожающих кровотечений [8 - 12]. ЕОК IIb C (УУР C, УДД 5).
- Всем пациентам с ИБС при возобновлении стенокардии после реваскуляризации миокарда рекомендуется провести стресс-методы визуализации для подтверждения наличия ишемии миокарда (эхокардиография с физической нагрузкой, или эхокардиография с фармакологической нагрузкой, или сцинтиграфия миокарда с функциональными пробами, или позитронно-эмиссионная томография миокарда, или однофотонная эмиссионная компьютерная томография миокарда перфузионная, с функциональными пробами) [8 - 12]. ЕОК I C (УУР C, УДД 5).
- Всем пациентам с ИБС при низком риске ССО (например, ишемия < 5% миокарда по данным стресс-визуализации с помощью сцинтиграфии миокарда) для улучшения прогноза и профилактики приступов стенокардии рекомендуется оптимальная медикаментозная терапия, описанная выше в разделе "Лечение" [8 - 12]. ЕОК I C (УУР C, УДД 5).
- Всем пациентам с ИБС при высоком риске ССО (например, ишемия > 10% миокарда по данным стресс-визуализации) рекомендуется провести КАГ для выявления показаний к реваскуляризации миокарда [8 - 12]. ЕОК I C (УУР C, УДД 5).
- У некоторых пациентов после ЧКВ высокого риска (например, при стентировании ствола левой КА) рекомендуется провести контрольную КАГ через 3 - 12 месяцев после вмешательства для контроля состояния стента для коронарных артерий***, исключения рестеноза/тромбоза и определения показаний для возможного повторного вмешательства [8 - 12]. ЕОК IIb C (УУР C, УДД 5).
- Повсеместное проведение контрольной КАГ в ранние и поздние сроки после ЧКВ, в отсутствие рецидивирования клинической симптоматики не рекомендуется [8 - 12]. ЕОК III C (УУР C, УДД 5).
- Трудоспособным пациентам со стабильной ИБС, чья профессиональная деятельность связана с потенциальным общественным риском (водители, крановщики, пилоты и пр.), после реваскуляризации миокарда рекомендуется проводить плановую нагрузочную пробу с визуализацией (эхокардиография с физической нагрузкой, или эхокардиография с фармакологической нагрузкой, или сцинтиграфия миокарда с функциональными пробами, или позитронно-эмиссионная томография миокарда, или однофотонная эмиссионная компьютерная томография миокарда перфузионная, с функциональными пробами) в ранние сроки (через 4 - 6 месяцев) после выписки из стационара для исключения скрытой ишемии миокарда [8 - 12]. ЕОК IIa C (УУР C, УДД 5).
- Пациентам с ИБС и сохраняющейся клиникой стенокардии любого ФК не рекомендуется участие в спортивных состязаниях и командных играх [8 - 12]. ЕОК III C (УУР C, УДД 5).
- Всем больным, перенесшим ИМ, КШ и ЧКВ со стентированием КА, страдающим стенокардией, рекомендованы тренировки умеренной интенсивности [ходьба, велосипед реабилитационный (велотренажер)] 3 раза в неделю продолжительностью до 30 минут для улучшения качества жизни пациентов с ИБС [8 - 12]. ЕОК IIa C (УУР C, УДД 5).
Комментарий. У пациентов с низким уровнем физической активности тренировочная программа должна быть максимально облегченной, с постепенным, по мере тренированности, увеличением нагрузки. Регулярные физические тренировки также помогают снизить избыточную массу тела, снизить повышенное АД. Физическое состояние пациента с ИБС во многом определяет и его способность к реализации сексуальной активности. Перед тем, как рекомендовать тот или иной вид физической активности, врач должен получить результаты нагрузочного теста с определением функциональных возможностей больного.
- Всем пациентам с ИБС рекомендуется ежегодная сезонная вакцинация против гриппа, особенно настоятельно - лицам пожилого возраста (в отсутствие абсолютных противопоказаний) для профилактики повторных ССО и улучшения качества жизни [8 - 12]. ЕОК I C (УУР C, УДД 5).
Организация оказания медицинской помощи
Показания для госпитализации
- Госпитализация пациентов со стабильной ИБС рекомендуется при сохранении высокого функционального класса стенокардии (III - IV ФК), несмотря на проводимое в полном объеме медикаментозное лечение для проведения инвазивных исследований и/или реваскуляризации миокарда [8 - 12]. ЕОК I C (УУР C, УДД 5).
- Госпитализация пациентов со стабильной ИБС рекомендуется при декомпенсации явлений СН, не поддающихся медикаментозному лечению на амбулаторном этапе [8 - 12]. ЕОК I C (УУР C, УДД 5).
- Госпитализация пациентов со стабильной ИБС рекомендуется при возникновении значимых или жизнеугрожающих нарушений ритма и/или проводимости сердца [8 - 12]. ЕОК I C (УУР C, УДД 5).
- Всех пациентов с подозрением на впервые возникшую стенокардию или обострение имевшейся ранее хронической ИБС (с подозрением на ОКС) рекомендуется экстренно госпитализировать, предпочтительно в стационар, где возможно инвазивное лечение [8 - 12]. ЕОК I C (УУР C, УДД 5).
Комментарий. Поскольку многим больным с подозрением на ОКС может потребоваться углубленная дифференциальная диагностика, их оптимально госпитализировать в многопрофильный стационар с возможностью экстренной диагностики и лечения острой коронарной и иной патологии. Больной с признаками высокого риска неблагоприятного исхода должен быть госпитализирован в стационар с возможностью инвазивного лечения. За более исчерпывающей информацией рекомендуется обратиться к Клиническим рекомендациям по лечению ОКС без подъема сегмента ST электрокардиограммы.
- На догоспитальном этапе не рекомендуется проведение диагностических мероприятий, направленных на подтверждение или исключение диагноза ОКС, исключая сбор жалоб и анамнеза, осмотр, запись ЭКГ [8 - 12]. ЕОК I C (УУР C, УДД 5).
Комментарий. Диагноз ОКС клинический, и никаких его подтверждений на догоспитальном этапе не требуется. Регистрация ЭКГ нужна для определения патогенетического варианта ОКС (ОКСпST или ОКСбпST) и, соответственно, необходимости срочного реперфузионного лечения. Любые догоспитальные диагностические мероприятия, которые могут задержать госпитализацию, неприемлемы.
- Пациентам с хронической ИБС вне обострения рекомендуется проходить лечение на амбулаторном этапе под наблюдением врача-терапевта или (при наличии показаний) врача-кардиолога [8 - 12]. ЕОК I C (УУР C, УДД 5).
- Пациентам с ИБС вне обострения рекомендуется госпитализация в стационар или дневной стационар для проведения КАГ (а также ряда диагностических исследований во время проведения КАГ) и госпитализация в стационар для реваскуляризации миокарда (ЧКВ или КШ) [8 - 12]. ЕОК I C (УУР C, УДД 5).
Показания к выписке пациента из стационара
- Пациентов с ИБС рекомендуется выписывать из стационара при условии клинической стабилизации состояния, после завершения оценки риска неблагоприятного исхода (включая проведение КАГ и/или неинвазивные стресс-тесты, перечисленные в разделе "Инструментальные диагностические исследования" в случаях, когда это показано) и реализации выбранной стратегии лечения [8, 11]. ЕОК I C (УУР C, УДД 5).
- После исключения диагноза ОКС всех пациентов с ИБС рекомендуется выписать на амбулаторный этап лечения или перевести в профильное отделение при выявлении другого основного заболевания, требующего госпитализации [8, 11]. ЕОК I C (УУР C, УДД 5).
Иные организационные технологии
- При подозрении на ОКС рекомендуется интенсивное наблюдение за пациентами с суточным прикроватным мониторированием жизненных функций и параметров, включая мониторирование ритма сердца, пока не будет подтверждено или отвергнуто наличие ОКС, не определен риск неблагоприятного исхода, не выбрана стратегия ведения пациента и исключены другие угрожающие жизни заболевания и осложнения [8 - 12, 220 - 223]. ЕОК I C (УУР B, УДД 2).
Комментарий. Мониторирование ритма сердца рекомендуется продлить при повышенном риске возникновения аритмий (нестабильность гемодинамики, имевшиеся серьезные аритмии, ФВ ЛЖ < 40%, безуспешные попытки реперфузионного лечения, сохраняющиеся критические стенозы в крупных коронарных артериях, осложнения при ЧКВ, сумма баллов по шкале GRACE > 140). У больных, не имеющих признаков продолжающейся ишемии миокарда, продление мониторирования ритма сердца возможно при подозрении на спазм коронарных артерий, а также при наличии симптомов, не позволяющих исключить аритмию.
6. Дополнительная информация, влияющая на течение и исход заболевания
Дополнительная информация отсутствует.
Критерии оценки качества медицинской помощи
N
Критерии качества
ЕОК класс и уровень
УУР
УДД
Да/Нет
1.
Выполнено электрокардиографическое исследование.
I C
C
1
2.
Выполнен общий (клинический) анализ крови развернутый.
I B
B
1
3.
Выполнен анализ крови биохимический общетерапевтический
I B
B
1
4.
Выполнен анализ крови биохимический по оценке липидного спектра (общий холестерин, холестерин липопротеидов низкой плотности, триглицериды).
I C
C
1
5.
Выполнена эхокардиография.
I B
B
1
6.
Выполнено дуплексное сканирование экстракраниальных отделов сонных артерий
II C
C
2
7.
Выполнен один из неинвазивных нагрузочных тестов для верификации ишемии при условии отсутствия противопоказаний.
IIb B
B
3
8.
Проведена терапия ацетилсалициловой кислотой** и гиполипидемическими средствами, ингибиторами ангиотензинпревращающего фермента и/или антагонистами рецепторов к ангиотензину II.
I A
A
1
9.
Назначена терапия бета-адреноблокаторами и/или блокаторами медленных кальциевых каналов и/или органическими нитратами.
I A
A
1
10.
Достигнуты рекомендованные целевые уровни Хс-ЛПНП < 1,4 ммоль/л на фоне назначенной терапии HMG CoA редуктазы ингибиторами, если не были достигнуты, то проведена интенсификация терапии (максимально переносимая доза HMG CoA редуктазы ингибиторов, при недостаточном эффекте - добавлен эзетимиб). При непереносимости статинов назначен эзетимиб.
I B
B
1
11.
Своевременно выполнены коронарография и хирургическое лечение (реваскуляризация миокарда при неэффективности оптимальной медикаментозной терапии).
I C
C
1
12.
Проведен повторный осмотр пациента и оценка эффективности терапии не более чем через 6 мес. от момента постановки диагноза ИБС.
III C
C
5
Список литературы
1. Sackett DL, Rosenberg WM, Gray JA et al. Evidence based medicine: what it is and what it isn"t. BMJ 1996; 312: 71 - 72.
2. Федеральный закон от 21.11.2011 N 323-ФЗ (ред. от 03.04.2017) "Об основах охраны здоровья граждан в Российской Федерации".
3. Эпидемиологический словарь: под ред. Джона М. Ласта для Международной эпидемиологической ассоциации. 4-е изд. М., 2009. 316 с.
4. ГОСТ Р 52379-2005. Надлежащая клиническая практика. М.: Стандартинформ, 2005. 39 с.
5. Федеральный закон от 12.04.2010 N 61-ФЗ (ред. от 03.07.2016) "Об обращении лекарственных средств".
6. Малая медицинская энциклопедия. М.: Медицинская энциклопедия, 1991 - 1996 гг. Режим доступа: http://dic.academic.ru/dic.nsf/enc_medicine/28878/Синдром.
7. Андреева Н.С., Реброва О.Ю., Зорин Н.А. и др. Системы оценки достоверности научных доказательств и убедительности рекомендаций: сравнительная характеристика и перспективы унификации. Медицинские технологии. Оценка и выбор. 2012; 4: 10 - 24.
8. Руководство по кардиологии: под ред. акад. Е.И. Чазова. В 4 т. М.: Издательский дом "Практика", 2014.
9. Карпов Ю.А., Сорокин Е.В. Стабильная ишемическая болезнь сердца: стратегия и тактика лечения. 2-е изд., перераб. и доп. М.: Медицинское информационное агентство, 2012. 271 с.
10. Карпов Ю.А., Кухарчук В.В., Лякишев А. и др. Диагностика и лечение хронической ишемической болезни сердца. Практические рекомендации. Кардиологический вестник 2015; 3: 3 - 33.
11. Кардиология: национальное руководство: под ред. Е.В. Шляхто. 2-е изд., перераб. и доп. М.: ГЭОТАР-Медиа, 2015. 800 с.
12. Knuuti J, Wijns W, Saraste A et al. 2019 ESC Guidelines for the diagnosis and management of chronic coronary syndromes. The Task Force for the diagnosis and management of chronic coronary syndromes of the European Society of Cardiology (ESC). Eur Heart J. 2019 Aug 31; pii: ehz425. doi:10.1093/eurheartj/ehz425
13. Campeau L. Letter: Grading of angina pectoris. Circulation 1976; 54: 522 - 523.
14. Международная классификация болезней МКБ-10. Режим доступа: http://www.mkb10.ru.
15. Thygesen K, Alpert JS, Jaffe AS, Chaitman BR, Bax JJ, Morrow DA, White HD. Fourth universal definition of myocardial infarction. European Heart Journal. 2019Jan 14; 40 (3): 237 - 269. doi:10.1093/eurheartj/ehy462
16. Диагностика и лечение стабильной ишемической болезни сердца. Клинические рекомендации. М.; 2013. 69 с.
17. Diamond GA, Forrester JS. Analysis of probability as an aid in the clinical diagnosis of coronary-artery disease. N Engl J Med. 1979; 300: 1350 - 1358.
18. Genders TS, Steyerberg EW, Alkadhi H, et al. A clinical prediction rule for the diagnosis of coronary artery disease: validation, updating, and extension. Eur Heart. J 2011; 32: 1316 - 1330.
19. Foldyna B, Udelson JE, Karady J et al. Pretest probability for patients with suspected obstructive coronary artery disease: re-evaluating Diamond-Forrester for the contemporary era and clinical implications: insights from the PROMISE trial. Eur Heart J Cardiovasc Imaging. 2018; 20: 574 - 581. doi:10.1093/ehjci/jey182
20. Adamson PD, Newby DE, Hill CL, et al. Comparison of international guidelines for assessment of suspected stable angina: insights from the PROMISE and SCOT-HEART. JACC Cardiovasc Imaging. 2018; 11: 1301 - 1310. doi:10.1016/j.jcmg.2018.06.021
21. Montalescot G, SechtemU, Achenbach Set al. 2013 ESC guidelines on the management of stable coronary artery disease: the Task Force on the management of stable Coronary artery disease of European Society of Cardiology. EurHeartJ 2013; 34, 2949 - 3003.
22. Арутюнов Г.П., Бойцов С.А., Воевода М.И. и др. Коррекция гипертриглицеридемии с целью снижения остаточного риска при заболеваниях, вызванных атеросклерозом. Заключение Совета экспертов. Российский кардиологический журнал. 2019; 9: 44 - 51. doi:10.15829/1560-4071-2019-9-44-51
23. Piepoli MF, Hoes AW, StefanAgewall S., et al. 2016 European Guidelines on cardiovascular disease prevention in clinical practice. The Sixth Joint Task Force of the European Society of Cardiology and Other Societies on Cardiovascular Disease Prevention in Clinical Practice. European Heart Journal. 2016 Aug 1; 37 (29): 2315 - 2381. doi:10.1093/eurheart/ehw106
24. Кухарчук В.В., Коновалов Г.А., Сусеков А.В. и др. Диагностика и коррекция нарушений липидного обмена с целью профилактики и лечения атеросклероза. Российские рекомендации, VI пересмотр. М., 2017. 44 с.
25. Catapano AL, Graham I, De Backer G, et al. 2016 ESC/EAS Guidelines for the management of dyslipidaemias. Eur Heart J. 2016; 37 (39): 2999 - 3058. doi:10.1093/eurheartj/ehw272
26. Cohn P.F., Fox K.M., Daly C. Silent myocardial ischemia. Circulation 2003; 108: 1263 - 1277.
27. Androulakis A., Aznaouridis K.A., Aggeli C.J., Roussakis G.N., Michaelides A.P., Kartalis A.N., Stougiannos P.N., Dilaveris P.E., Misovoulos P.I., Stefanadis C.I., Kallikazaros I.E. Transient ST-segment depression during paroxysms of atrial fibrillation in otherwise normal inpiduals: relation with underlying coronary artery disease. J Am Coll Cardiol 2007; 50: 1909 - 1911
28. Steeds R.P., Garbi M., Cardim N. et al. EACVI appropriateness criteria for the use of transthoracic echocardiography in adults: a report of literature and current practice review. Eur Heart J Cardiovasc Imaging. 2017; 18: 1191 - 1204. doi:10.1093/ehjci/jew333
29. Daly C.A., De Stavola B., Sendon J.L., et al. Predicting prognosis in stable angina - results from the Euro heart survey of stable angina: prospective observational study. BMJ. 2006; 332: 262 - 267.
30. Smedsrud M.K., Gravning J., Omland T., et al. Sensitive cardiac troponins and N-terminal pro-B-type natriuretic peptide in stable coronary artery disease: correlation with left ventricular function as assessed by myocardial strain. Int J Cardiovasc Imaging. 2015; 31: 967 - 973. doi:10.1007/s10554-015-0646-6
31. Senior R, Becher H, Monaghan M et al. Clinical practice of contrast echocardiography: recommendation by the European Association of Cardiovascular Imaging (EACVI) 2017. EurHeartJCardiovascImaging 2017; 18: 1205 - 1205af. doi:10.1093/ehjci/jex182
32. Thomson H.L., Basmadjian A.J., Rainbird A.J., Razavi M., Avierinos J.F., Pellikka P.A. et al. Contrast echocardiography improves the accuracy and reproducibility of left ventricular remodeling measurements: a prospective, randomly assigned, blinded study. J Am Coll Cardiol 2001; 38: 867 - 875
33. Greenwood JP, Ripley DP, Berry C, et al. Effect of care guided by cardiovascular magnetic resonance, myocardial perfusion scintigraphy, or NICE guidelines on subsequent unnecessary angiography rates: the CE-MARC 2 randomized clinical trial. JAMA. 2016; 316: 1051 - 1060.
34. Boogers MJ, Broersen A, Van Velzen JE et al. Automated quantification of coronary plaque with computed tomography: comparison with intravascular ultrasound using a dedicated registration algorithm for fusion-based quantification. Eur. Heart J. 2012; 33 (8): 1007 - 1016.
35. Touboul P.J., Hennerici M.G., Meairs S., Adams H., Amarenco P., Desvarieux M., Ebrahim S., Fatar M., Hernandez H.R, Kownator S., Prati P., Rundek T., Taylor A., Bornstein N., Csiba L., Vicaut E., Woo K.S., Zannad F., Advisory Board of the 3rd Watching the Risk Symposium 2004, 13th European Stroke Conference. Mannheim intima-media thickness consensus. Cerebrovasc Dis 2004; 18: 346 - 349
36. Vlachopoulos C., Xaplanteris P., Aboyans V., Brodmann M., Cifkova R., Cosentino F., et al. The role of vascular biomarkers for primary and secondary prevention. A position paper from the European Society of Cardiology Working Group on peripheral circulation: endorsed by the Association for Research into Arterial Structure and Physiology (ARTERY) Society. Atherosclerosis 2015; 241: 507 - 532
37. Forslund L, Hjemdahl P, Held C, Bjorkander I, Eriksson SV, Rehnqvist N. Ischaemia during exercise and ambulatory monitoring in patients with stable angina pectoris and healthy controls. Gender differences and relationships to catecholamines. Eur Heart J. 1998; 19: 578 - 587.
38. Davies RF, Goldberg AD, Forman S, et al. Asymptomatic Cardiac Ischemia Pilot (ACIP) study two-year follow-up: outcomes of patients randomized to initial strategies of medical therapy versus revascularization. Circulation. 1997; 95: 2037 - 2043.
39. Stone PH, Chaitman BR, Forman S, et al. Prognostic significance of myocardial ischemia detected by ambulatory electrocardiography, exercise treadmill testing, and electrocardiogram at rest to predict cardiac events by one year (the Asymptomatic Cardiac Ischemia Pilot [ACIP] study). Am J Cardiol. 1997; 80: 1395 - 1401.
40. Versteylen M.O., Joosen I.A., Shaw L.J., Narula J., Hofstra L. Comparison of Framingham, PROCAM, SCORE, and Diamond Forrester to predict coronary atherosclerosis and cardiovascular events. J Nucl Cardiol. 2011; 18: 904 - 911.
41. Fordyce C.B., Douglas P.S., Roberts R.S. et al. Identification of patients with stable chest pain deriving minimal value from noninvasive testing: the PROMISE minimal-risk tool, a secondary analysis of a randomized clinical trial. JAMA Cardiol. 2017; 2: 400 - 408. doi:10.1001/jamacardio.2016.5501
42. Jensen J.M., Voss M., Hansen V.B. et al. Risk stratification of patients suspected of coronary artery disease: comparison of five different models. Atherosclerosis. 2012; 220: 557 - 562.
43. Budoff M.J., Mayrhofer T., Ferencik M. et al. Prognostic value of coronary artery calcium in the PROMISE study (Prospective Multicenter Imaging Study for Evaluation of Chest Pain). Circulation. 2017; 136: 1993 - 2005. doi:10.1161/CIRCULATIONAHA.117.030578
44. Reeh J., Therming C.B., Heitmann M. et al. Prediction of obstructive coronary artery disease and prognosis in patients with suspected stable angina. Eur Heart J. 2018; 40: 1426 - 1435. doi:10.1093/eurheartj/ehy806
45. Siontis GC, Mavridis D, Greenwood JP, et al. Outcomes of non-invasive diagnostic modalities for the detection of coronary artery disease: network meta-analysis of diagnostic randomised controlled trials. BMJ. 2018; 360: k504. Published 2018 Feb 21. doi:10.1136/bmj.k504
46. Hoffmann U, Ferencik M, Udelson JE et al. Prognostic value of noninvasive cardiovascular testing in patients with stable chest pain: insights from the PROMISE trial (Prospective Multicenter Imaging Study for Evaluation of Chest Pain). Circulation. 2017; 135: 2320 - 2332. doi:10.1161/CIRCULATIONAHA.116.024360
47. Siontis GC, Mavridis D, Greenwood JP, et al. Outcomes of non-invasive diagnostic modalities for the detection of coronary artery disease: network meta-analysis of diagnostic randomised controlled trials. BMJ. 2018; 360: k504. doi:10.1136/bmj.k504
48. Knuuti J, Ballo H, Juarez-Orozco LE, et al. The performance of non-invasive tests to rule-in and rule-out significant coronary artery stenosis in patients with stable angina: a meta-analysis focused on post-test disease probability. Eur Heart J. 2018; 39: 3322 - 3330.
49. Zacharias K, Ahmed A, Shah BN, et al. Relative clinical and economic impact of exercise echocardiography vs. exercise electrocardiography, as first line investigation in patients without known coronary artery disease and new stable angina: a randomized prospective study. Eur Heart J Cardiovasc Imaging. 2017; 18: 195 - 202. doi:10.1093/ehjci/jew049
50. Williams MC, Hunter A, Shah ASV, et al. Use of coronary computed tomographic angiography to guide management of patients with coronary disease. J Am Coll Cardiol. 2016; 67: 1759 - 1768. doi:10.1016/j.jacc.2016.02.026
51. Knuuti J, Bengel F, Bax JJ et al. Risks and benefits of cardiac imaging: an analysis of risks related to imaging for coronary artery disease. Eur Heart J. 2014; 35: 633 - 638.
52. Jorgensen ME, Andersson C, Norgaard BL, et al. Functional testing or coronary computed tomography angiography in patients with stable coronary artery disease. J AmColl Cardiol. 2017; 69: 1761 - 1770. doi:10.1016/j.jacc.2017.01.046
53. Roifman I, Wijeysundera HC, Austin PC, et al. Comparison of anatomic and clinical outcomes in patients undergoing alternative initial noninvasive testing strategies for the diagnosis of stable coronary artery disease. J Am Heart Assoc. 2017; 6: e005462. doi:10.1161/JAHA.116.005462
54. Navare SM, Mather JF, Shaw LJ, Fowler MS, Heller GV. Comparison of risk stratification with pharmacologic and exercise stress myocardial perfusion imaging: a meta-analysis. J Nucl Cardiol. 2004; 11 (5): 551 - 561. doi:10.1016/j.nuclcard.2004.06.128.
55. Koshy AN, Ha FJ, Gow PJ, et al. Computed tomographic coronary angiography in risk stratification prior to non-cardiac surgery: a systematic review and meta-analysis. Heart. 2019; 105 (17): 1335 - 1342. doi:10.1136/heartjnl-2018-314649.
56. Johnson NP, Toth GG, Lai D et al. Prognostic value of fractional flow reserve: linking physiologic severity to clinical outcomes. J Am Coll Cardiol. 2014; 64: 1641 - 1654.
57. Barbato E, Toth GG, Johnson NP, et al. A prospective natural history study of coronary atherosclerosis using fractional flow reserve. J Am Coll Cardiol. 2016; 68: 2247 - 2255. doi:10.1016/j.jacc.2016.08.055
58. Меркулов Е.В., Миронов В.М., Самко А.Н. Коронарная ангиография, вентрикулография, шунтография. В иллюстрациях и схемах. М.: Медиа-Медика, 2011. 100 с.
59. Zimmermann FM, Omerovic E, Fournier S et al. Fractional flow reserve-guided percutaneous coronary intervention vs. medical therapy for patients with stable coronary lesions: meta-analysis of inpidual patient data. Eur Heart J. 2019 Jan 7; 40 (2): 180 - 186. doi:10.1093/eurheartj/ehy812
60. Emond M, Mock MB, Davis KB, Fisher LD, Holmes DR Jr, Chaitman BR, Kaiser GC, Alderman E, Killip T III. Long-term survival of medically treated patients in the Coronary Artery Surgery Study (CASS) Registry. Circulation 1994; 90: 2645 - 2657
61. DeBruyne B, Pijls NH, Kalesan B et al. Fractional flow reserve-guided PCI versus medical therapy in stable coronary disease. N Engl J Med. 2012; 367: 991 - 1001.
62. Chamuleau SA, Meuwissen M, Koch KT, et al. Usefulness of fractional flow reserve for risk stratification of patients with multivessel coronary artery disease and an intermediate stenosis. Am J Cardiol. 2002; 89 (4): 377 - 380. doi:10.1016/s0002-9149(01)02255-x
63. Миронов В.М., Меркулов Е.В., Терещенко А.С., Самко А.Н., Соломянный В.В., Тагиева Н.Р., Сергиенко И.В., Карпов Ю.А. Измерение фракционного резерва кровотока для выбора тактики лечения пациентов с многососудистым и многоуровневым поражением коронарного русла. Атеросклероз и дислипидемии, 2014. N 2(15) с. 17 - 22
64. Liou K, Negishi K, Ho S, Russell EA, Cranney G, Ooi SY. Detection of Obstructive Coronary Artery Disease Using Peak Systolic Global Longitudinal Strain Derived by Two-Dimensional Speckle-Tracking: A Systematic Review and Meta-Analysis. J Am Soc Echocardiogr. 2016; 29 (8): 724 - 735. e4. doi:10.1016/j.echo.2016.03.002
65. Sara JD, Widmer RJ, Matsuzawa Y, et al. Prevalence of coronary microvascular dysfunction among patients with chest pain and nonobstructive coronary artery disease. JACC Cardiovasc Interv. 2015; 8: 1445 - 1453.
66. Lee BK, Lim HS, Fearon WF, et al. Invasive evaluation of patients with angina in the absence of obstructive coronary artery disease. Circulation. 2015; 131: 1054 - 1060.
67. Ong P, Athanasiadis A, Borgulya G et al. Clinical usefulness, angiographic characteristics, and safety evaluation of intracoronary acetylcholine provocation testing among 921 consecutive white patients with unobstructed coronary arteries. Circulation. 2014; 129: 1723 - 1730.
68. Schoenenberger AW, Adler E, Gujer S et al. Prognostic value of an abnormal response to acetylcholine in patients with angina and non-obstructive coronary artery disease: long-term follow-up of the Heart Quest cohort. Int J Cardiol. 2016; 221: 539 - 545. doi:10.1016/j.ijcard.2016.07.035
69. Aziz A, Hansen HS, Sechtem U, Prescott E, Ong P. Sex-related differences in vasomotor function in patients with angina and unobstructed coronary arteries. J Am Coll Cardiol. 2017; 70: 2349 - 2358. doi:10.1016/j.jacc.2017.09.016
70. Beltrame JF, Crea F, Kaski JC et al. International standardization of diagnostic criteria for vasospastic angina. Eur Heart J. 2017; 38: 2565 - 2568. doi:10.1093/eurheartj/ehv351
71. JCS Joint Working Group. Guidelines for diagnosis and treatment of patients with vasospastic angina (Coronary Spastic Angina) (JCS 2013). Circ J. 2014; 78: 2779 - 2801.
72. Ford TJ, Stanley B, Good R, et al. Stratified medical therapy using invasive coronary function testing in angina: the CorMicA trial. J Am Coll Cardiol. 2018; 72: 2841 - 2855.
73. Baumgartner H, Falk V, Bax JJ et al. 2017 ESC/EACTS Guidelines for the management of valvular heart disease. Eur Heart J. 2017; 38: 2739 - 2791.
74. Kass M, Allan R, Haddad H. Diagnosis of graft coronary artery disease. Curr Opin Cardiol. 2007; 22: 139 - 145.
75. Baris N, Sipahi I, Kapadia SR, et al. Coronary angiography for follow-up of heart transplant recipients: insights from TIMI frame count and TIMI myocardial perfusion grade. J Heart Lung Transplant. 2007; 26: 593 - 597.
76. Zimmer RJ, Lee MS. Transplant coronary artery disease. JACC Cardiovasc Interv. 2010; 3: 367 - 377.
77. D'Ascenzo F, Barbero U, Cerrato E, et al. Accuracy of intravascular ultrasound and optical coherence tomography in identifying functionally significant coronary stenosis according to vessel diameter: a meta-analysis of 2,581 patients and 2,807 lesions. Am Heart J. 2015; 169 (5): 663 - 673. doi:10.1016/j.ahj.2015.01.013
78. Waksman R, Legutko J, Singh J et al. FIRST: Fractional Flow Reserve and Intravascular Ultrasound Relationship Study. J Am Coll Cardiol. 2013; 61: 917 - 923.
79. Park SJ, Ahn JM, Kang SJ, et al. Intravascular ultrasound-derived minimal lumen area criteria for functionally significant left main coronary artery stenosis. JACC Cardiovasc Interv. 2014; 7: 868 - 874.
80. Ben-Dor I, Torguson R, Deksissa T et al. Intravascular ultrasound lumen area parameters for assessment of physiological ischemia by fractional flow reserve in intermediate coronary artery stenosis. Cardiovasc Revasc Med. 2012 May-Jun; 13 (3): 177 - 82.
81. Mark DB, Shaw L, Harrell FE Jr, et al. Prognostic value of a treadmill exercise score in outpatients with suspected coronary artery disease. N Engl J Med. 1991; 325: 849 - 853.
82. Maaniitty T, Stenstrom I, Bax JJ et al. Prognostic value of coronary CT angiography with selective PET perfusion imaging in coronary artery disease. JACC Cardiovasc Imaging. 2017; 10: 1361 - 1370. doi:10.1016/j.jcmg.2016.10.025
83. SCOT-HEART investigators. CT coronary angiography in patients with suspected angina due to coronary heart disease (SCOT-HEART): an open-label, parallel-group, multicentre trial. Lancet. 2015; 385: 2383 - 2391.
84. Williams B, Mancia G, Spiering W et al. 2018 ESC/ESH Guidelines for the management of arterial hypertension. Eur Heart J. 2018; 39 (33): 3021 - 3104. doi:10.1093/eurheartj/ehy339
85. Ettehad D, Emdin CA, Kiran A, et al. Blood pressure lowering for prevention of cardiovascular disease and death: a systematic review and meta-analysis. Lancet. 2016; 387: 957 - 967.
86. Xie X, Atkins E, Lv J, Bennett A et al. Effects of intensive blood pressure lowering on cardiovascular and renal outcomes: updated systematic review and meta-analysis. Lancet. 2016; 387: 435 - 443. doi:10.1016/S0140-6736(15)00805-3
87. Antithrombotic Trialists' (ATT) Collaboration, Baigent C, Blackwell L, Collins R, et al. Aspirin 3567 in the primary and secondary prevention of vascular disease: collaborative meta-analysis of 3568 inpidual participant data from randomized trials. Lancet. 2009; 373: 1849 - 1860. doi:10.1016/S0140-6736(09)60503-1
88. CAPRIE Steering Committee. A randomized, blinded, trial of clopidogrel versus aspirin in patients at risk of ischemic events (CAPRIE). Lancet. 1996; 348: 1329 - 1339. doi:10.1016/s0140-6736(96)09457-3
89. Mauri L, Kereiakes DJ, Yeh RW, Driscoll-Shempp P, Cutlip DE, Steg PG, Normand SL, Braunwald E, Wiviott SD, Cohen DJ, Holmes DR Jr, Krucoff MW, Hermiller J, Dauerman HL, Simon DI, Kandzari DE, Garratt KN, Lee DP, Pow TK, Ver Lee P, Rinaldi MJ, Massaro JM; DAPT Study Investigators. Twelve or 30 months of dual antiplatelet therapy after drug-eluting stents. N Engl J Med 2014; 371: 2155 - 2166
90. Mega JL, Braunwald E, Wiviott SD, Bassand JP, Bhatt DL, Bode C, Burton P, Cohen M, Cook-Bruns N, Fox KA, Goto S, Murphy SA, Plotnikov AN, Schneider D, Sun X, Verheugt FW, Gibson CM; ATLAS ACS 2TIMI 51 Investigators. Rivaroxaban in patients with a recent acute coronary syndrome. N Engl J Med 2012; 366: 919.
91. Eikelboom JW, Connolly SJ, Bosch J, Dagenais GR, Hart RG, Shestakovska O, Diaz R, Alings M, Lonn EM, Anand SS, Widimsky P, Hori M, Avezum A, Piegas LS, Branch KRH, Probstfield J, Bhatt DL, Zhu J, Liang Y, Maggioni AP, LopezJaramillo P, O'Donnell M, Kakkar AK, Fox KAA, Parkhomenko AN, Ertl G, Stork S, Keltai M, Ryden L, Pogosova N, Dans AL, Lanas F, Commerford PJ, Torp-Pedersen C, Guzik TJ, Verhamme PB, Vinereanu D, Kim JH, Tonkin AM, Lewis BS, Felix C, Yusoff K, Steg PG, Metsarinne KP, Cook Bruns N, Misselwitz F, Chen E, Leong D, Yusuf S; COMPASS Investigators. Rivaroxaban with or without aspirin in stable cardiovascular disease. N Engl J Med 2017; 377: 13191330
92. Bonaca MP, Bhatt DL, Cohen M, Steg PG, Storey RF, Jensen EC, Magnani G, Bansilal S, Fish MP, Im K, Bengtsson O, Oude Ophuis T, Budaj A, Theroux P, Ruda M, Hamm C, Goto S, Spinar J, Nicolau JC, Kiss RG, Murphy SA, Wiviott SD, Held P, Braunwald E, Sabatine MS; PEGASUS-TIMI 54 Steering Committee and Investigators. Long-term use of ticagrelor in patients with prior myocardial infarction. N Engl J Med 2015; 372: 17911800.
93. Bertrand ME, Legrand V, Boland J, Fleck E, Bonnier J, Emmanuelson H, Vrolix M, Missault L, Chierchia S, Casaccia M, Niccoli L, Oto A, White C, WebbPeploe M, Van Belle E, McFadden EP. Randomized multicenter comparison of conventional anticoagulation versus antiplatelet therapy in unplanned and elective coronary stenting. Circulation 1998; 98: 1597 - 1603.
94. Urban P, Macaya C, Rupprecht HJ, Kiemeneij F, Emanuelsson H, Fontanelli A, Pieper M, Wesseling T, Sagnard L. Randomized evaluation of anticoagulation versus antiplatelet therapy after coronary stent implantation in high-risk patients: the multicenter aspirin and ticlopidine trial after intracoronary stenting (MATTIS). Circulation 1998; 98: 2126 - 2132.
95. Valgimigli M, Bueno H, Byrne RA, Collet JP, Costa F, Jeppsson A, Juni P, Kastrati A, Kolh P, Mauri L, Montalescot G, Neumann FJ, Petricevic M, Roffi M, Steg PG, Windecker S, Zamorano JL, Levine GN. 2017 ESC focused update on dual antiplatelet therapy in coronary artery disease developed in collaboration with EACTS: The Task Force for dual antiplatelet therapy in coronary artery disease of the European Society of Cardiology (ESC) and of the European Association for Cardio-Thoracic Surgery (EACTS). Eur Heart J 2018; 39: 213260
96. Michelson AD. Antiplatelet therapies for the treatment of cardiovascular disease. Nat Rev Drug Discov. 2010 Feb; 9 (2): 154 - 69. doi:10.1038/nrd2957
97. Lopes RD, Heizer G, Aronson R, Vora AN, Massaro T, Mehran R, Goodman SG, Windecker S, Darius H, Li J, Averkov O, Bahit MC, Berwanger O, Budaj A, Hijazi Z, Parkhomenko A, Sinnaeve P, Storey RF, Thiele H, Vinereanu D, Granger CB, Alexander JH; AUGUSTUS Investigators. Antithrombotic therapy after acute coronary syndrome or PCI in atrial fibrillation. N Engl J Med 2019; 380: 15091524.
98. Cannon CP, Bhatt DL, Oldgren J, Lip GYH, Ellis SG, Kimura T, Maeng M, Merkely B, Zeymer U, Gropper S, Nordaby M, Kleine E, Harper R, Manassie J, Januzzi JL, Ten Berg JM, Steg PG, Hohnloser SH; RE-DUAL PCI Steering Committee and Investigators. Dual antithrombotic therapy with dabigatran after PCI in atrial fibrillation. N Engl J Med 2017; 377: 15131524.
99. Gibson CM, Mehran R, Bode C, Halperin J, Verheugt FW, Wildgoose P, Birmingham M, Ianus J, Burton P, van Eickels M, Korjian S, Daaboul Y, Lip GY, Cohen M, Husted S, Peterson ED, Fox KA. Prevention of bleeding in patients with atrial fibrillation undergoing PCI. N Engl J Med 2016; 375: 24232434.
100. Giugliano RP, Ruff CT, Braunwald E, Murphy SA, Wiviott SD, Halperin JL, Waldo AL, Ezekowitz MD, Weitz JI, Spinar J, Ruzyllo W, Ruda M, Koretsune Y, Betcher J, Shi M, Grip LT, Patel SP, Patel I, Hanyok JJ, Mercuri M, Antman EM; ENGAGE AF-TIMI 48 Investigators. Edoxaban versus warfarin in patients with atrial fibrillation. N Engl J Med 2013; 369: 20932104.
101. Kirchhof P, Benussi S, Kotecha D, Ahlsson A, Atar D, Casadei B, Castella M, Diener HC, Heidbuchel H, Hendriks J, Hindricks G, Manolis AS, Oldgren J, Popescu BA, Schotten U, Van Putte B, Vardas P. 2016 ESC Guidelines for the management of atrial fibrillation developed in collaboration with EACTS. Eur Heart J 2016; 37: 28932962.
102. Hurlen M, Abdelnoor M, Smith P, Erikssen J, Arnesen H. Warfarin, aspirin, or both after myocardial infarction. N Engl J Med 2002; 347: 969974
103. Renato D. Lopes, MD, PhD1; Sergio Leonardi, MD, MHS2; Daniel M. Wojdyla, MS1; Amit N. Vora, MD, MPH3; Laine Thomas, PhD1; Robert F. Storey, BSc, BM, DM4; Dragos Vinereanu, MD, PhD5; Christopher B. Granger, MD1; Shaun G. Goodman, MD, MSc6; Ronald Aronson, MD7; Stephan Windecker, MD8; Holger Thiele, MD9; Marco Valgimigli, MD, PhD8; Roxana Mehran, MD10; John H. Alexander, MD, MHS1 Stent Thrombosis in Patients with Atrial Fibrillation Undergoing Coronary Stenting in the AUGUSTUS Trial. Doi 10.1161/CIRCULATIONAHA.119.044584
104. Bhatt DL, Cryer BL, Contant CF, et al. Clopidogrel with or without Omeprazole in Coronary Artery Disease. N Engl J Med. 2010; 363: 1909 - 1917. doi:10.1056/NEJMoa1007964
105. Kwok C, Shing, Jeevanantham V, Dawn B, Loke YK. No consistent evidence of differential cardiovascular risk amongst proton-pump inhibitors when used with clopidogrel: Meta-analysis. Int J Cardiol. 2012; 167: 965 - 974.
106. Huang B, Huang Y, Li Y, Yao H, Jing X, Huang H, Li J. Adverse Cardiovascular Effects of Concomitant Use of Proton Pump Inhibitors and Clopidogrel in Patients with Coronary Artery Disease: A Systematic Review and Meta-Analysis. Archives of Medical Research. 2012; 43: 212 - 224.
107. Melloni C, Washam JB, Jones WS et al. Conflicting Results Between Randomized Trials and Observational Studies on the Impact of Proton Pump Inhibitors on Cardiovascular Events When Coadministered With Dual Antiplatelet Therapy. Systematic Review. CircCardiovascQual Outcomes. 2015; 8: 47 - 55. doi:10.1161/CIRCOUTCOMES.114.001177
108. Sehested TSG, Carlson N, Hansen PW, et al. Reduced risk of gastrointestinal bleeding associated with proton pump inhibitor therapy in patients treated with dual antiplatelet therapy after myocardial infarction. EurHeart J. 2019; 40: 1963 - 1970. doi:10.1093/eurheartj/ehz104
109. Mach F, Baigent C, Catapano AL, et al. 2019 ESC/EAS Guidelines for the management of dyslipidaemias: lipid modification to reduce cardiovascular risk. Eur Heart J. 2019 Aug 31; pii: ehz455. doi:10.1093/eurheartj/ehz455
110. Murphy SA, Pedersen TR, Gaciong ZA et al. Effect of the PCSK9 Inhibitor Evolocumab on Total Cardiovascular Events in Patients With Cardiovascular Disease: A Prespecified Analysis From the FOURIER Trial. JAMA Cardiol. 2019 Jul 1; 4 (7): 613 - 619. doi:10.1001/jamacardio.2019.0886
111. Szarek M, White HD, Schwartz GG, et al. Alirocumab Reduces Total Nonfatal Cardiovascular and Fatal Events: The ODYSSEY OUTCOMES Trial. J Am Coll Cardiol. 2019; 73: 387 - 396. doi:10.1016/j.jacc.2018.10.039
112. Pitt B, Zannad F, Remme WJ et al. The effect of spironolactone on morbidity and mortality in patients with severe heart failure. Randomized Aldactone Evaluation Study Investigators. N Engl J Med. 1999; 341: 709 - 717.
113. Rossignol P, Girerd N, Bakris G et al. Impact of eplerenone on cardiovascular outcomes in heart failure patients with hypokalaemia. Eur J Heart Fail. 2017; 19: 792 - 799. doi: 10.1002/ejhf.688
114. Ponikowski P, Voors AA, Anker SD et al. 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: The Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC)Developed with the special contribution of the Heart Failure Association (HFA) of the ESC. Eur Heart J. 2016; 37: 2129 - 2200.
115. Pauly DF, Johnson BD, Anderson RD et al. In women with symptoms of cardiac ischemia, nonobstructive coronary arteries, and microvascular dysfunction, angiotensin-converting enzyme inhibition is associated with improved microvascular function: a double-blind randomized study from the National Heart, Lung and Blood Institute Women's Ischemia Syndrome Evaluation (WISE). Am Heart J. 2011; 162: 678684.
116. Ong P, Athanasiadis A, Sechtem U. Pharmacotherapy for coronary microvascular dysfunction. Eur Heart J Cardiovasc Pharmacother. 2015; 1: 6571.
117. Crea F, Lanza G. Treatment of microvascular angina: the need for precision medicine. European Heart Journal. (2016) 37, 1514 - 1516. doi:10.1093/eurheartj/ehw021
118. Buxton A, Goldberg S, Hirshfeld JW, et al. Refractory ergonovine-induced coronary vasospasm: importance of intracoronary nitroglycerin. Am J Cardiol. 1980; 46: 329334.
119. Сергиенко В.Б., Самойленко Е., Саютина Е.В. и др. Роль дисфункции эндотелия в развитии ишемии миокарда у больных ИБС с неизмененными и малоизмененными коронарными артериями. Кардиология. 1999; 1: 25 - 30.
120. Tsuburaya R, Takahashi J, Nakamura A et al. Beneficial effects of long acting nifedipine on coronary vasomotion abnormalities after drug-eluting stent implantation: the NOVEL study. Eur Heart J. 2016; 37: 27132721.
121. Boden WE, O'Rourke RA, Teo KK et al.; COURAGE Trial Research Group. Optimal medical therapy with or without PCI for stable coronary disease. N Engl J Med 2007; 356: 1503 - 1516.
122. BARI Study Group 2D, Frye RL, August P et al. A randomized trial of therapies for type 2 diabetes and coronary artery disease. N Engl J Med 2009; 360: 2503 - 2515.
123. Hueb W, Lopes N, Gersh BJ et al. Ten-year follow-up survival of the Medicine, Angioplasty, or Surgery Study (MASS II): A randomized controlled clinical trial of 3 therapeutic strategies for multivessel coronary artery disease. Circulation 2010; 122: 949 - 957.
124. Yusuf S, Zucker D, Peduzzi P et al. Effect of coronary artery bypass graft surgery on survival: Overview of 10-year results from randomized trials by the Coronary Artery Bypass Graft Surgery Trialists Collaboration. Lancet. 1994; 344: 563 - 570.
125. Bittl JA, He Y, Jacobs AK et al. American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines. Bayesian methods affirm the use of percutaneous coronary intervention to improve survival in patients with unprotected left main coronary artery disease. Circulation 2013; 127: 2177 - 2185.
126. Dzavik V, Ghali WA, Norris C, Mitchell LB, Koshal A, Saunders LD, Galbraith PD, Hui W, Faris P, Knudtson ML, Alberta for Provincial Project in Outcome Assessment Coronary Heart Disease Investigators. Long-term survival in 11,661 patients with multivessel coronary artery disease in the era of stenting: A report from the Alberta Provincial Project for Outcome Assessment in Coronary Heart Disease (APPROACH) Investigators. Am Heart J 2001; 142: 119 - 126.
127. Lee PH, Ahn JM, Chang M, Baek S, Yoon SH, Kang SJ, Lee SW, Kim YH, Lee CW, Park SW, Park DW, Park SJ. Left main coronary artery disease: Secular trends in patient characteristics, treatments, and outcomes. J Am Coll Cardiol 2016; 68: 1233 - 1246.
128. Smith PK, Califf RM, Tuttle RH, Shaw LK, Lee KL, Delong ER, Lilly RE, Sketch MH Jr, Peterson ED, Jones RH. Selection of surgical or percutaneous coronary intervention provides differential longevity benefit. Ann Thorac Surg 2006; 82: 1420 - 1428; discussion 1428 - 1429.
129. Hannan EL, Wu C, Walford G, Culliford AT, Gold JP, Smith CR, Higgins RS, Carlson RE, Jones RH. Drug-eluting stents vs. coronary-artery bypass grafting in multivessel coronary disease. N Engl J Med 2008; 358: 331 - 341.
130. Hannan EL, Samadashvili Z, Cozzens K, Walford G, Jacobs AK, Holmes DR Jr, Stamato NJ, Gold JP, Sharma S, Venditti FJ, Powell T, King SB III. Comparative outcomes for patients who do and do not undergo percutaneous coronary intervention for stable coronary artery disease in New York. Circulation 2012; 125: 1870 - 1879.
131. Caracciolo EA, Davis KB, Sopko G, Kaiser GC, Corley SD, Schaff H, Taylor HA, Chaitman BR. Comparison of surgical and medical group survival in patients with left main equivalent coronary artery disease. Long-term CASS experience. Circulation 1995; 91: 2335 - 2344.
132. Chaitman BR, Hardison RM, Adler D, Gebhart S, Grogan M, Ocampo S, Sopko G, Ramires JA, Schneider D, Frye RL; Bypass Angioplasty Revascularization Investigation 2 Diabetes Study G. The Bypass Angioplasty Revascularization Investigation 2 Diabetes randomized trial of different treatment strategies in type 2 diabetes mellitus with stable ischemic heart disease: Impact of treatment strategy on cardiac mortality and myocardial infarction. Circulation 2009; 120: 2529 - 2540.
133. Passamani E, Davis KB, Gillespie MJ, Killip T. A randomized trial of coronary artery bypass surgery. Survival of patients with a low ejection fraction. N Engl J Med 1985; 312: 1665 - 1671.
134. Velazquez EJ, Lee KL, Deja MA, Jain A, Sopko G, Marchenko A, Ali IS, Pohost G, Gradinac S, Abraham WT, Yii M, Prabhakaran D, Szwed H, Ferrazzi P, Petrie MC, O'Connor CM, Panchavinnin P, She L, Bonow RO, Rankin GR, Jones RH, Rouleau JL; STICH Investigators. Coronary-artery bypass surgery in patients with left ventricular dysfunction. N Engl J Med 2011; 364: 1607 - 1616.
135. Jones RH, Kesler K, Phillips HR III, Mark DB, Smith PK, Nelson CL, Newman MF, Reves JG, Anderson RW, Califf RM. Long-term survival benefits of coronary artery bypass grafting and percutaneous transluminal angioplasty in patients with coronary artery disease. J Thorac Cardiovasc Surg 1996; 111: 1013 - 1025.
136. Baker DW, Jones R, Hodges J, Massie BM, Konstam MA, Rose EA. Management of heart failure. III. The role of revascularization in the treatment of patients with moderate or severe left ventricular systolic dysfunction. JAMA 1994; 272: 1528 - 1534.
137. Velazquez EJ, Lee KL, Jones RH, Al-Khalidi HR, Hill JA, Panza JA, Michler RE, Bonow RO, Doenst T, Petrie MC, Oh JK, She L, Moore VL, Desvigne-Nickens P, Sopko G, Rouleau JL; STICHES Investigators. Coronary-artery bypass surgery in patients with ischemic cardiomyopathy. N Engl J Med 2016; 374: 1511 - 1520.
138. Panza JA, Velazquez EJ, She L, Smith PK, Nicolau JC, Favaloro RR, Gradinac S, Chrzanowski L, Prabhakaran D, Howlett JG, Jasinski M, Hill JA, Szwed H, Larbalestier R, Desvigne-Nickens P, Jones RH, Lee KL, Rouleau JL. Extent of coronary and myocardial disease and benefit from surgical revascularization in ischemic LV dysfunction [Corrected]. J Am Coll Cardiol 2014; 64: 553 - 561.
139. Petrie MC, Jhund PS, She L, Adlbrecht C, Doenst T, Panza JA, Hill JA, Lee KL, Rouleau JL, Prior DL, Ali IS, Maddury J, Golba KS, White HD, Carson P, Chrzanowski L, Romanov A, Miller AB, Velazquez EJ, STICH Trial Investigators. Ten-year outcomes after coronary artery bypass grafting according to age in patients with heart failure and left ventricular systolic dysfunction: An analysis of the extended follow-up of the STICH trial (Surgical Treatment for Ischemic Heart Failure). Circulation 2016; 134: 1314 - 1324.
140. Shaw LJ, Berman DS, Maron DJ, Mancini GB, Hayes SW, Hartigan PM, Weintraub WS, O'Rourke RA, Dada M, Spertus JA, Chaitman BR, Friedman J, Slomka P, Heller GV, Germano G, Gosselin G, Berger P, Kostuk WJ, Schwartz RG, Knudtson M, Veledar E, Bates ER, McCallister B, Teo KK, Boden WE; COURAGE Investigators. Optimal medical therapy with or without percutaneous coronary intervention to reduce ischemic burden: Results from the Clinical Outcomes Utilizing Revascularization and Aggressive Drug Evaluation (COURAGE) trial nuclear substudy. Circulation 2008; 117 (10): 1283 - 1291.
141. Hachamovitch R, Hayes SW, Friedman JD, Cohen I, Berman DS. Comparison of the short-term survival benefit associated with revascularization compared with medical therapy in patients with no prior coronary artery disease undergoing stress myocardial perfusion single photon emission computed tomography. Circulation 2003; 107: 2900 - 2907.
142. Gada H, Kirtane AJ, Kereiakes DJ, Bangalore S, Moses JW, Genereux P, Mehran R, Dangas GD, Leon MB, Stone GW. Meta-analysis of trials on mortality after percutaneous coronary intervention compared with medical therapy in patients with stable coronary heart disease and objective evidence of myocardial ischemia. Am J Cardiol 2015; 115: 1194 - 1199.
143. Stergiopoulos K, Boden WE, Hartigan P, Mobius-Winkler S, Hambrecht R, Hueb W, Hardison RM, Abbott JD, Brown DL. Percutaneous coronary intervention outcomes in patients with stable obstructive coronary artery disease and myocardial ischemia: A collaborative meta-analysis of contemporary randomized clin-ical trials. JAMA Intern Med 2014; 174: 232 - 240.
144. Nishigaki K, Yamazaki T, Kitabatake A, Yamaguchi T, Kanmatsuse K, Kodama I, Takekoshi N, Tomoike H, Hori M, Matsuzaki M, Takeshita A, Shimbo T, Fujiwara H; Japanese Stable Angina Pectoris Study Investigators. Percutaneous coronary intervention plus medical therapy reduces the incidence of acute coronary syndrome more effectively than initial medical therapy only among patients with low-risk coronary artery disease a randomized, comparative, multicenter study. JACC Cardiovasc Interv 2008; 1: 469 - 479.
145. Al-Lamee R, Thompson D, Dehbi HM, Sen S, Tang K, Davies J, Keeble T, Mielewczik M, Kaprielian R, Malik IS, Nijjer SS, Petraco R, Cook C, Ahmad Y, Howard J, Baker C, Sharp A, Gerber R, Talwar S, Assomull R, Mayet J, Wensel R, Collier D, Shun-Shin M, Thom SA, Davies JE, Francis DP, ORBITA Investigators. Percutaneous coronary intervention in stable angina (ORBITA): A double-blind, randomised controlled trial. Lancet 2018; 391: 31 - 40
146. Katritsis DG, Ioannidis JP. Percutaneous coronary intervention versus conservative therapy in nonacute coronary artery disease: A meta-analysis. Circulation 2005; 111: 2906 - 2912.
147. Schomig A, Mehilli J, de Waha A, Seyfarth M, Pache J, Kastrati A. A meta-analysis of 17 randomized trials of a percutaneous coronary intervention-based strategy in patients with stable coronary artery disease. J Am Coll Cardiol 2008; 52: 894 - 904.
148. Trikalinos TA, Alsheikh-Ali AA, Tatsioni A, Nallamothu BK, Kent DM. Percutaneous coronary interventions for non-acute coronary artery disease: A quantitative 20-year synopsis and a network meta-analysis. Lancet 2009; 373: 911 - 918.
149. Bangalore S, Pursnani S, Kumar S, Bagos PG. Percutaneous coronary intervention versus optimal medical therapy for prevention of spontaneous myocardial infarction in subjects with stable ischemic heart disease. Circulation 2013; 127: 769 - 781.
150. Pursnani S, Korley F, Gopaul R, Kanade P, Chandra N, Shaw RE, Bangalore S. Percutaneous coronary intervention versus optimal medical therapy in stable coronary artery disease: A systematic review and meta-analysis of randomized clinical trials. Circ Cardiovasc Interv 2012; 5: 476 - 490.
151. Thomas S, Gokhale R, Boden WE, Devereaux PJ. A meta-analysis of randomized controlled trials comparing percutaneous coronary intervention with medical therapy in stable angina pectoris. Can J Cardiol 2013; 29: 472 - 482.
152. DeBruyne B, Fearon WF, Pijls NH, Barbato E, Tonino P, Piroth Z, Jagic N, Mobius-Winckler S, Rioufol G, Witt N, Kala P, MacCarthy P, Engstrom T, Oldroyd K, Mavromatis K, Manoharan G, Verlee P, Frobert O, Curzen N, Johnson JB, Limacher A, Nuesch E, Juni P; FAME-2 Trial Investigators. Fractional flow reserve-guided PCI for stable coronary artery disease. N Engl J Med 2014; 371: 1208 - 1217.
153. Миронов В.М., Меркулов Е.В., Самко А.Н. Оценка фракционного резерва кровотока. Кардиология. 2012; 52 (8): 46 - 56.
154. Witberg G, Regev E, Chen S et al. The prognostic effects of coronary disease severity and completeness of revascularization on mortality in patients undergoing transcatheter aortic valve replacement. JACC Cardiovasc Interv. 2017; 10: 1428 - 1435.
155. Chakravarty T, Sharma R, Abramowitz Y, et al. Outcomes in patients with transcatheter aortic valve replacement and left main stenting: the TAVR-LM registry. J Am Coll Cardiol. 2016; 67: 951 - 960.
156. Kaikita K, Ogawa H. [Guidelines for Diagnosis and Treatment of Patients with Vasospastic Angina (Coronary Spastic Angina) (Revised Version 2013). Nihon Rinsho. 2016 Aug; 74 Suppl 6: 54 - 7. Japanese. PubMed PMID: 30540370.
157. Tanabe Y, Itoh E, Suzuki K, Ito M, Hosaka Y, Nakagawa I, et al. Limited role of coronary angioplasty and stenting in coronary spastic angina with organic stenosis. J Am Coll Cardiol 2002; 39: 1120 - 1126.
158. Corcos T, David PR, Bourassa MG, Val PG, Robert J, Mata LA, et al. Percutaneous transluminal coronary angioplasty for the treatment of variant angina. J Am Coll Cardiol 1985; 5: 1046 - 1054.
159. Bertrand ME, LaBlanche JM, Thieuleux FA, Fourrier JL, Traisnel G, Asseman P. Comparative results of percutaneous transluminal coronary angioplasty in patients. J Am Coll Cardiol 1986; 8: 504 - 508.
160. Prinzmetal M, Ekmekci A, Kennamer R, Kwoczynski JK, Shubin H, Toyoshima H. Variantform of angina pectoris, previously undelineated syndrome. JAMA 1960; 174: 1794 - 1800.
161. MacAlpin RN. Relation of coronary arterial spasm to sites of organic stenosis. Am J Cardiol 1980; 46: 143 - 153.
162. Jeremias A, Kaul S, Rosengart TK, Gruberg L, Brown DL. The impact of revascularization on mortality in patients with nonacute coronary artery disease. Am J Med 2009; 122: 152 - 161.
163. Aziz O, Rao C, Panesar SS, Jones C, Morris S, Darzi A, Athanasiou T. Meta-analysis of minimally invasive internal thoracic artery bypass versus percutaneous revascularisation for isolated lesions of the left anterior descending artery. BMJ 2007; 334: 617.
164. Kapoor JR, Gienger AL, Ardehali R, Varghese R, Perez MV, Sundaram V, McDonald KM, Owens DK, Hlatky MA, Bravata DM. Isolated disease of the proximal left anterior descending artery comparing the effectiveness of percutaneous coronary interventions and coronary artery bypass surgery. JACC Cardiovasc Interv 2008; 1: 483 - 491.
165. Blazek S, Holzhey D, Jungert C, Borger MA, Fuernau G, Desch S, Eitel I, de Waha S, Lurz P, Schuler G, Mohr FW, Thiele H. Comparison of bare-metal stenting with minimally invasive bypass surgery for stenosis of the left anterior descending coronary artery: 10-year follow-up of a randomized trial. JACC Cardiovasc Interv 2013; 6: 20 - 26.
166. Hannan EL, Zhong Y, Walford G, Holmes DR Jr, Venditti FJ, Berger PB, Jacobs AK, Stamato NJ, Curtis JP, Sharma S, King SB III. Coronary artery bypass graft surgery versus drug-eluting stents for patients with isolated proximal left anterior descending disease. J Am Coll Cardiol 2014; 64: 2717 - 2126.
167. Blazek S, Rossbach C, Borger MA, Fuernau G, Desch S, Eitel I, Stiermaier T, Lurz P, Holzhey D, Schuler G, Mohr FW, Thiele H. Comparison of sirolimus-eluting stenting with minimally invasive bypass surgery for stenosis of the left anterior descending coronary artery: 7-year follow-up of a randomized trial. JACC Cardiovasc Interv 2015; 8: 30 - 38.
168. Thiele H, Neumann-Schniedewind P, Jacobs S, Boudriot E, Walther T, Mohr FW, Schuler G, Falk V. Randomized comparison of minimally invasive direct coronary artery bypass surgery versus sirolimus-eluting stenting in isolated proximal left anterior descending coronary artery stenosis. J Am Coll Cardiol 2009; 53: 2324 - 2331.
169. Capodanno D, Stone GW, Morice MC, Bass TA, Tamburino C. Percutaneous coronary intervention versus coronary artery bypass graft surgery in left main coronary artery disease: A meta-analysis of randomized clinical data. J Am Coll Cardiol 2011; 58: 1426 - 1432.
170. Giacoppo D, Colleran R, Cassese S, Frangieh AH, Wiebe J, Joner M, Schunkert H, Kastrati A, Byrne RA. Percutaneous coronary intervention vs coronary artery bypass grafting in patients with left main coronary artery stenosis: A systematic review and meta-analysis. JAMA Cardiol 2017; 2: 1079 - 1088.
171. Serruys PW, Morice MC, Kappetein AP, Colombo A, Holmes DR, Mack MJ, Stahle E, Feldman TE, van den Brand M, Bass EJ, Van Dyck N, Leadley K, Dawkins KD, Mohr FW; SYNTAX Investigators S. Percutaneous coronary intervention versus coronary-artery bypass grafting for severe coronary artery dis-ease. N Engl J Med 2009; 360: 961 - 972.
172. Park SJ, Ahn JM, Kim YH, Park DW, Yun SC, Lee JY, Kang SJ, Lee SW, Lee CW, Park SW, Choo SJ, Chung CH, Lee JW, Cohen DJ, Yeung AC, Hur SH, Seung KB, Ahn TH, Kwon HM, Lim DS, Rha SW, Jeong MH, Lee BK, Tresukosol D, Fu GS, Ong TK; BEST Trial Investigators. Trial of everolimus-eluting stents or bypass surgery for coronary disease. N Engl J Med 2015; 372: 1204 - 1212.
173. Chang M, Ahn JM, Lee CW, Cavalcante R, Sotomi Y, Onuma Y, Tenekecioglu E, Han M, Park DW, Kang SJ, Lee SW, Kim YH, Park SW, Serruys PW, Park SJ. Long-term mortality after coronary revascularization in nondiabetic patients with multivessel disease. J Am Coll Cardiol 2016; 68: 29 - 36
174. Head SJ, Davierwala PM, Serruys PW, et al. Coronary artery bypass grafting vs. percutaneous coronary intervention for patients with three-vessel disease: Final five-year follow-up of the SYNTAX trial. Eur Heart J. 2014; 35: 2821 - 2830.
175. Hakeem A, Garg N, Bhatti S, Rajpurohit N, Ahmed Z, Uretsky BF. Effectiveness of percutaneous coronary intervention with drug-eluting stents compared with bypass surgery in diabetics with multivessel coronary disease: Comprehensive systematic review and meta-analysis of randomized clinical data. J Am Heart Assoc 2013; 2: e000354.
176. Herbison P, Wong CK. Has the difference in mortality between percutaneous coronary intervention and coronary artery bypass grafting in people with heart disease and diabetes changed over the years? A systematic review and meta-regression. BMJ Open 2015; 5: e010055.
177. Kamalesh M, Sharp TG, Tang XC, Shunk K, Ward HB, Walsh J, King S III, Colling C, Moritz T, Stroupe K, Reda D; CARDS Investigators VA. Percutaneous coronary intervention versus coronary bypass surgery in United States veterans with diabetes. J Am Coll Cardiol 2013; 61: 808 - 816.
178. Kappetein AP, Head SJ, Morice MC, Banning AP, Serruys PW, Mohr FW, Dawkins KD, Mack MJ, Investigators S. Treatment of complex coronary artery disease in patients with diabetes: 5-year results comparing outcomes of bypass surgery and percutaneous coronary intervention in the SYNTAX trial. Eur J Cardiothorac Surg 2013; 43: 1006 - 1013.
179. Kapur A, Hall RJ, Malik IS, Qureshi AC, Butts J, de Belder M, Baumbach A, Angelini G, de Belder A, Oldroyd KG, Flather M, Roughton M, Nihoyannopoulos P, Bagger JP, Morgan K, Beatt KJ. Randomized comparison of percutaneous coronary intervention with coronary artery bypass grafting in dia-betic patients. 1-year results of the CARDia (Coronary Artery Revascularization in Diabetes) trial. J Am Coll Cardiol 2010; 55: 432 - 440.
180. Koskinas KC, Siontis GC, Piccolo R, Franzone A, Haynes A, Rat-Wirtzler J, Silber S, Serruys PW, Pilgrim T, Raber L, Heg D, Juni P, Windecker S. Impact of diabetic status on outcomes after revascularization with drug-eluting stents in relation to coronary artery disease complexity: Patient-level pooled analysis of 6081 patients. Circ Cardiovasc Interv 2016; 9: e003255.
181. Windecker S, Stortecky S, Stefanini GG, et al. Revascularisation versus medical treatment in patients with stable coronary artery disease: Network meta-analysis. BMJ. 2014; 348: g3859.
182. Bonaa KH, Mannsverk J, Wiseth R et al. Drug-eluting or bare-metal stents for coronary artery disease. N Engl J Med. 2016; 375: 1242 - 1252.
183. Palmerini T, Benedetto U, Biondi-Zoccai G et al. Long-term safety of drug-eluting and bare-metal stents: Evidence from a comprehensive network meta-analysis. J Am Coll Cardiol. 2015; 65: 2496 - 2507.
184. Stefanini GG, Byrne RA, Windecker S. State of the art: coronary artery stent - past, present and future. EuroIntervention. 2017; 13 (6): 706 - 716. doi:10.4244/EIJ-D-17-00557
185. Sabate M, Windecker S, Iniguez A et al. Everolimus-eluting bioresorbable stent vs. durable polymer everolimus-eluting metallic stent in patients with ST-segment elevation myocardial infarction: Results of the randomized ABSORB ST-segment elevation myocardial infarction-TROFI II trial. Eur Heart J. 2016; 37: 229 - 240. doi:10.1093/eurheartj/ehv500
186. Cassese S, Byrne RA, Ndrepepa G et al. Everolimus-eluting bioresorbable vascular scaffolds versus everolimus-eluting metallic stents: A meta-analysis of randomized controlled trials. Lancet. 2016; 387: 537 - 544. doi:10.1016/S0140-6736(15)00979-4
187. Cassese S, Byrne RA, Juni P, et al. Midterm clinical outcomes with everolimus-eluting bioresorbable scaffolds versus everolimus-eluting metallic stents for percutaneous coronary interventions: A meta-analysis of randomized trials. EuroIntervention. 2018; 13: 1565 - 1573. doi:10.4244/EIJ-D-17-00492
188. Valgimigli M, Gagnor A, Calabro P et al. Radial versus femoral access in patients with acute coronary syndromes undergoing invasive management: A randomized multicentre trial. Lancet. 2015; 385: 2465 - 2476. doi:10.1016/S0140-6736(15)60292-6
189. Jolly SS, Yusuf S, Cairns J, et al. Radial versus femoral access for coronary angiography and intervention in patients with acute coronary syndromes (RIVAL): A randomized, parallel group, multicentre trial. Lancet. 2011; 377: 1409 - 1420.
190. Ferrante G, Rao SV, Juni P, et al. Radial versus femoral access for coronary interventions across the entire spectrum of patients with coronary artery disease: A meta-analysis of randomized trials. JACC Cardiovasc Interv. 2016; 9: 1419 - 1434. doi:10.1016/j.jcin.2016.04.014
191. Neumann FJ, Sousa-Uva M, Ahlsson A et al. 2018 ESC/EACTS Guidelines on myocardial revascularization. Eur Heart J. 2019 Jan 7; 40 (2): 87 - 165. doi:10.1093/eurheartj/ehy394
192. Gaudino M, Angelini G D, Antoniades C et al. Off-Pump Coronary Artery Bypass Grafting: 30 Years of Debate. J Am Heart Assoc. 2018; 7 (16): e009934. doi:10.1161/JAHA.118.009934
193. Melby SJ, Saint LL, Balsara K et al. Complete coronary revascularization improves survival in octogenarians. Ann Thorac Surg. 2016; 102: 505 - 511.
194. Taggart DP, Altman DG, Gray AM et al. Randomized trial of bilateral versus single internal-thoracic-artery grafts. N Engl J Med. 2016; 375: 2540 - 2549. doi:10.1056/NEJMoa1610021
195. Gaudino M, Tranbaugh R, Fremes S. Bilateral versus single internal thoracic artery grafts. N Engl J Med. 2017; 376: e37. doi:10.1056/NEJMc1703358
196. Gaudino M, Benedetto U, Fremes S, et al. Radial-artery or saphenous-vein grafts in coronary-artery bypass surgery. N Engl J Med. 2018; 378: 2069 - 2077. doi:10.1056/NEJMoa1716026
197. Arora RR, Chou TM, Jain D, et al. Effects of enhanced external counter pulsation on Health-Related Quality of Life continue 12 months after treatment: a sub study of the Multicenter Study of Enhanced External Counter pulsation. J Investig Med. 2002; 50: 25 - 32.
198. Zipes DP, Svorkdal N, Berman D, et al. Spinal cord stimulation therapy for patients with refractory angina who are not candidates for revascularization. Neuromodulation. 2012; 15: 550 - 558.
199. Henry TD, Losordo DW, Traverse JH et al. Autologous CD34+ cell therapy improves exercise capacity, angina frequency and reduces mortality in no-option refractory angina: a patient-level pooled analysis of randomized double-blinded trials. Eur Heart J. 2018; 39: 2208 - 2216.
200. Briones E, Lacalle JR, Marin-Leon I, Rueda JR. Transmyocardial laser revascularization versus medical therapy for refractory angina. Cochrane Database Syst Rev. 2015; 2: CD003712.
201. HM Dalal, P Doherty, RS Taylor. Cardiac rehabilitation. BMJ 2015; 351: h5000 doi: 10.1136/bmj.h5000
202. Taylor RS, Brown A, Ibrahim S et al. Exercise-based rehabilitation for patients with coronary heart disease: systematic review and meta-analysis of randomized controlled trials. Am J Med. 2004; 116: 682 - 692. doi:10.1016/j.amjmed.2004.01.009
203. Clark AM, Hurtling L, Vandermeer B, McAlister FA. Meta-analysis: secondary prevention programs for patients with coronary artery disease. Ann Intern Med. 2005; 143: 659 - 672.
204. Постановление Правительства РФ от 16.05.2019 N 607 "О внесении изменений в Правила признания лица инвалидом".
205. Taylor RS, Unal B, Critchley JA, Capewell S. Mortality reductions in patients receiving exercise-based cardiac rehabilitation: how much can be attributed to cardiovascular risk factor improvements? Eur J Cardiovasc Prev Rehabil. 2006; 13: 369 - 374.
206. Chow CK, Jolly S, Rao-Melacini P, Fox KA, Anand SS, Yusuf S. Association of diet, exercise, and smoking modification with risk of early cardiovascular events after acute coronary syndromes. Circulation. 2010; 121: 750 - 758.
207. Aldcroft SA, Taylor NF, Blackstock FC, O"Halloran PD. Psychoeducational rehabilitation for health behavior change in coronary artery disease: a systematic review of controlled trials. J Cardiopulm Rehabil Prev. 2011; 31: 273 - 281.
208. Heran BS, Chen JM, Ebrahim S, Moxham T, Oldridge N, Rees K, Thompson DR, Taylor RS. Exercise-based cardiac rehabilitation for coronary heart disease. Cochrane Database Syst Rev. 2011; 1: CD001800.
209. Janssen V, De Gucht V, Dusseldorp E, Maes S. Lifestyle modification programmes for patients with coronary heart disease: a systematic review and meta-analysis of randomized controlled trials. Eur J Prev Cardiol. 2013; 20: 620 - 640.
210. Booth JN, 3rd, Levitan EB, Brown TM, Farkouh ME, Safford MM, Muntner P. Effect of sustaining lifestyle modifications (nonsmoking, weight reduction, physical activity, and Mediterranean diet) after healing of myocardial infarction, percutaneous intervention, or coronary bypass (from the Reasons for Geographic and Racial Differences in Stroke Study). Am J Cardiol. 2014; 113: 1 933 - 40. doi:10.1016/j.amjcard.2014.03.033
211. Burning RS, Sturek M. Benefits of exercise training on coronary blood flow in coronary artery disease patients. Prog Cardiovasc Dis. 2015; 57: 443 - 453.
212. Anderson L, Oldridge N, Thompson DR, Zwisler AD, Rees K, Martin N, Taylor RS. Exercise-based cardiac rehabilitation for coronary heart disease: Cochrane systematic review and meta-analysis. J Am Coll Cardiol. 2016; 67: 1 - 12. doi:10.1016/j.jacc.2015.10.044
213. Rauch B, Davos CH, Doherty P, et al. The prognostic effect of cardiac rehabilitation in the era of acute revascularization and statin therapy: A systematic review and meta-analysis of randomized and non-randomized studies - The Cardiac Rehabilitation Outcome Study (CROS). Eur J Prev Cardiol 2016; 23: 1914 - 1939. doi:10.1177/2047487316671181
214. Benzer W, Rauch B, Schmid JP, et al. Exercise-based cardiac rehabilitation in twelve European countries results of the 4916 European cardiac rehabilitation registry. Int J Cardiol. 2017; 228: 58 - 67. doi:10.1016/j.ijcard.2016.11.059
215. Stewart RAH, Held C, Hadziosmanovic N, et al. Physical Activity and Mortality in Patients With Stable Coronary Heart Disease. J Am Coll Cardiol. 2017; 70: 1689 - 1700. doi:10.1016/j.jacc.2017.08.017
216. Cheng W, Zhang Z, Cheng W, Yang C, Diao L, Liu W. Associations of leisure-time physical activity with cardiovascular mortality: A systematic review and meta-analysis of 44 prospective cohort studies. Eur J Prev Cardiol. 2018; 25: 1864 - 1872.
217. Lahtinen M, Toukola T, Junttila MJ, et al. Effect of Changes in Physical Activity on Risk for Cardiac Death in Patients With Coronary Artery Disease. Am J Cardiol. 2018; 12: 143 - 148. doi:10.1016/j.amjcard.2017.10.002
218. Voogdt-Pruis HR, Beusmans GH, Gorgels AP, Kester AD, Van Ree JW. Effectiveness of nurse-delivered cardiovascular risk management in primary care: a randomized trial. Br J Gen Pract. 2010; 60: 40 - 46.
219. Wood DA, Kotseva K, Connolly S, et al. Nurse-coordinated multidisciplinary, family-based cardiovascular disease prevention programme (EUROACTION) for patients with coronary heart disease and asymptomatic inpiduals at high risk of cardiovascular disease: a paired, cluster-randomized controlled trial. Lancet. 2008; 371: 1999 - 2012. doi:10.1016/S0140-6736(08)60868-5
220. Slater DK, Hlatky MA, Mark DB, et al. Outcome in suspected acute myocardial infarction with normal or minimally abnormal admission electrocardiographic findings. Am J Cardiol. 1987 Oct 1; 60 (10): 766 - 770. doi:10.1016/0002-9149(87)91020-4
221. Lev EI, Battler A, Behar S, Porter A, Haim M et al. Frequency, characteristics and outcome of patients hospitalized with acute coronary syndromes with undetermined electrocardiographic patterns. Am J Cardiol. 2003 Jan 15; 91 (2): 224 - 227. doi:10.1016/s0002-9149(02)03111-9
222. Rahimi K, Watzlawek S, Thiele H et al. Incidence, time course, and predictors of early malignant ventricular arrhythmias after non-ST-segment elevation myocardial infarction in patients with early invasive treatment. Eur Heart J. 2006; 27: 1706 - 1711. doi:10.1093/eurheartj/ehl100
223. Piccini JP, White JA, Mehta RH, et al. Sustained ventricular tachycardia and ventricular fibrillation complicating non-ST-segment-elevation acute coronary syndromes. Circulation. 2012; 126: 41 - 49. doi:10.1161/CIRCULATIONAHA.111.071860.
224. Takx RA, Blomberg BA, El Aidi H, et al. Diagnostic accuracy of stress myocardial perfusion imaging compared to invasive coronary angiography with fractional flow reserve meta-analysis. Circ Cardiovasc Imaging. 2015; 8 (1): e002666. doi:10.1161/CIRCIMAGING.114.002666
225. Danad I, Szymonifka J, Twisk JWR, et al. Diagnostic performance of cardiac imaging methods to diagnose ischaemia-causing coronary artery disease when directly compared with fractional flow reserve as a reference standard: a meta-analysis. Eur Heart J. 2017; 38 (13): 991 - 998. doi:10.1093/eurheartj/ehw095
226. Abdelmoneim SS, Dhoble A, Bernier M, et al. Quantitative myocardial contrast echocardiography during pharmacological stress for diagnosis of coronary artery disease: a systematic review and meta-analysis of diagnostic accuracy studies. Eur J Echocardiogr. 2009; 10 (7): 813 - 825. doi:10.1093/ejechocard/jep084
227. Mowatt G, Brazzelli M, Gemmell H, et al. Systematic review of the prognostic effectiveness of SPECT myocardial perfusion scintigraphy in patients with suspected or known coronary artery disease and following myocardial infarction. Nucl Med Commun. 2005; 26 (3): 217 - 229. doi:10.1097/00006231-200503000-00006
Приложение А1
СОСТАВ РАБОЧЕЙ ГРУППЫ
Председатели рабочей группы:
Барбараш Ольга Леонидовна
Карпов Юрий Александрович
Члены рабочей группы:
Акчурин Ринат Сулейманович
Алекян Баграт Гегамович
Аронов Давид Меерович
Беленков Юрий Никитич
Бойцов Сергей Анатольевич
Болдуева Светлана Афанасьевна
Бощенко Алла Александровна
Бубнова Марина Геннадьевна
Васюк Юрий Александрович
Габинский Ян Львович
Галявич Альберт Сарварович
Глезер Мария Генриховна
Голубев Евгений Павлович
Голухова Елена Зеликовна
Гринштейн Юрий Исаевич
Давидович Илья Михайлович
Ежов Марат Владиславович
Карпов Ростислав Сергеевич
Кореннова Ольга Юрьевна
Космачева Елена Дмитриевна
Кашталап Василий Васильевич
Кошельская Ольга Анатольевна
Кухарчук Валерий Владимирович
Лопатин Юрий Михайлович
Миронов Всеволод Михайлович
Марцевич Сергей Юрьевич
Миролюбова Ольга Алексеевна
Михин Вадим Петрович
Недошивин Александр Олегович
Олейников Валентин Эливич
Панов Алексей Владимирович
Панченко Елизавета Павловна
Перепеч Никита Борисович
Петрова Марина Михайловна
Поздняков Юрий Михайлович
Протасов Константин Викторович
Руда Мария Михайловна
Савенков Михаил Петрович
Самко Анатолий Николаевич
Скибицкий Виталий Викентьевич
Соболева Галина Николаевна
Шалаев Сергей Владимирович
Шапошник Игорь Иосифович
Шевченко Алексей Олегович
Шевченко Олег Петрович
Ширяев Андрей Андреевич
Шляхто Евгений Владимирович
Чумакова Галина Александровна
Якушин Сергей Степанович
Члены Рабочей группы подтвердили отсутствие финансовой поддержки/конфликта интересов. В случае сообщения о наличии конфликта интересов член(ы) рабочей группы был(и) исключен(ы) из обсуждения разделов, связанных с областью конфликта интересов.
Приложение А2
МЕТОДОЛОГИЯ РАЗРАБОТКИ КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ
Клинические рекомендации разработаны специалистами-экспертами Российского кардиологического общества, Национального общества по изучению атеросклероза, Научного общества по атеротромбозу - на основе достижений доказательной медицины, отечественного и зарубежного клинического опыта в области стабильной ИБС, атеросклероза и сердечно-сосудистой профилактики. Основой настоящей версии клинических рекомендаций стали российские и зарубежные фундаментальные руководства и монографии по кардиологии и внутренним болезням, результаты крупных международных медицинских регистров и рандомизированных исследований, последние версии европейских и американских методических руководств для специалистов-кардиологов и врачей общей практики. Источниками современных обновлений были журнальные публикации в авторитетных рецензируемых журналах, входящих в российские и зарубежные индексы научного цитирования.
Целевая аудитория данных клинических рекомендаций:
1. Врач-кардиолог медицинских организаций, оказывающий помощь в амбулаторных и стационарных условиях.
2. Врач-терапевт медицинских организаций, оказывающий помощь в амбулаторных и стационарных условиях.
3. Врач общей практики (семейный врач).
4. Врач-сердечно-сосудистый хирург.
5. Врач по рентгенэноваскулярным методам диагностики и лечения.
В ходе разработки использованы международные шкалы уровня убедительности рекомендаций и уровня достоверности доказательств (Таблицы ПА2-1 и ПА2-2), а также новая система шкал УДД и УУР для лечебных, реабилитационных, профилактических вмешательств и диагностических вмешательств (Таблицы ПА2-3, ПА2-4 и ПА2-5), введенная в 2018 г. ФГБУ ЦЭККМП Минздрава РФ. Вследствие того, что члены Российского кардиологического общества входят в состав Европейского общества кардиологов и также являются его членами, все рекомендации Европейского общества кардиологов (ЕОК) формируются с участием российских экспертов, которые являются соавторами европейских рекомендаций. Таким образом, существующие рекомендации ЕОК отражают общее мнение ведущих российских и европейских кардиологов. В связи с этим формирование Национальных рекомендаций проводилось на основе рекомендаций ЕОК, с учетом национальной специфики, особенностей обследования, лечения, учитывающих доступность медицинской помощи. По этой причине в тексте настоящих клинических рекомендаций, одновременно использованы две шкалы оценки достоверности доказательств тезисов рекомендаций: уровни достоверности доказательств ЕОК с УУР и УДД. Добавлены классы рекомендаций ЕОК, позволяющие оценить необходимость выполнения тезиса рекомендаций.
Таблица ПА2-1. Классы показаний согласно рекомендациям Европейского общества кардиологов (ЕОК).
Класс рекомендаций ЕОК
Определение
Предлагаемая формулировка
I
Доказано или общепризнанно, что диагностическая процедура, вмешательство/лечение являются эффективными и полезными
Рекомендовано/показано
II
Противоречивые данные и/или мнения об эффективности/пользе диагностической процедуры, вмешательства, лечения
IIa
Большинство данных/мнений в пользу эффективности/пользы диагностической процедуры, вмешательства, лечения
Целесообразно применять
Эффективность/польза диагностической процедуры, вмешательства, лечения установлены менее убедительно
IIb
Можно применять
III
Данные или единое мнение, что диагностическая процедура, вмешательство, лечение бесполезны /неэффективны, а в ряде случаев могут приносить вред.
Не Рекомендуется применять
Таблица ПА2-2. Уровни достоверности доказательств согласно рекомендациям Европейского общества кардиологов (ЕОК).
Уровни достоверности доказательств ЕОК
A
Данные многочисленных рандомизированных клинических исследований или мета-анализов
B
Данные получены по результатам одного рандомизированного клинического исследования или крупных нерандомизированных исследований
C
Согласованное мнение экспертов и/или результаты небольших исследований, ретроспективных исследований, регистров
Таблица ПА2-3. Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств)
УДД
Расшифровка
1
Систематические обзоры исследований с контролем референсным методом или систематический обзор рандомизированных клинических исследований с применением мета-анализа
2
Отдельные исследования с контролем референсным методом или отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований с применением мета-анализа
3
Исследования без последовательного контроля референсным методом, или исследования с референсным методом, не являющимся независимым от исследуемого метода, или нерандомизированные сравнительные исследования, в том числе когортные исследования
4
Несравнительные исследования, описание клинического случая
5
Имеется лишь обоснование механизма действия или мнение экспертов
Таблица ПА2-4. Шкала оценки уровней достоверности доказательств (УДД) для методов профилактики, лечения и реабилитации (профилактических, лечебных, реабилитационных вмешательств)
УДД
Расшифровка
1
Систематический обзор РКИ с применением метаанализа
2
Отдельные РКИ и систематические обзоры исследований любого дизайна, за исключением РКИ, с применением мета-анализа
3
Нерандомизированные сравнительные исследования, в т.ч. когортные исследования
4
Несравнительные исследования, описание клинического случая или серии случаев, исследования "случай-контроль"
5
Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов
Таблица ПА2-5. Шкала оценки уровней убедительности рекомендаций (УУР) для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств)
УУР
Расшифровка
A
Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными)
B
Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными)
C
Слабая рекомендация (отсутствие доказательств надлежащего качества (все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными)
Порядок обновления клинических рекомендаций
Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию - не реже чем один раз в три года или при появлении новой информации о тактике ведения пациентов с данным заболеванием. Решение об обновлении принимает МЗ РФ на основе предложений, представленных медицинскими некоммерческими профессиональными организациями. Сформированные предложения должны учитывать результаты комплексной оценки лекарственных препаратов, медицинских изделий, а также результаты клинической апробации.
Приложение А3
СВЯЗАННЫЕ ДОКУМЕНТЫ
1. Приказ Министерства здравоохранения Российской Федерации от 15 ноября 2012 г. N 918н "Об утверждении Порядка оказания медицинской помощи больным с сердечно-сосудистыми заболеваниями".
2. Приказ Министерства здравоохранения Российской Федерации от 15 июля 2016 г. N 520н "Об утверждении критериев оценки качества медицинской помощи".
3. Приказ Министерства здравоохранения РФ от 29 марта 2019 г. N 173н "Об утверждении порядка проведения диспансерного наблюдения за взрослыми".
4. Методические рекомендации по оценке достоверности доказательств и убедительности рекомендаций. ФГБУ ЦЭККМП Минздрава России, 2018.
Справочная информация
Таблица ПА3-1. Функциональные классы стенокардии
Функциональный класс I
Функциональный класс II
Функциональный класс III
Функциональный класс IV
Обычная для пациента физическая нагрузка не вызывает приступов стенокардии.
Приступы стенокардии возникают при средней физической нагрузке: быстрой ходьбе, после приема пищи, при выходе на холод, ветре, при эмоциональном стрессе, подъеме в гору, по лестнице более чем на один этаж (> 2 пролетов) или в течение нескольких часов после пробуждения.
Приступы стенокардии резко ограничивают физическую активность:
возникают при незначительной физической нагрузке:
ходьбе в среднем темпе
до 500 м, при подъеме по лестнице на 1 - 2 пролета. Изредка приступы возникают в покое.
Неспособность к выполнению любой, даже минимальной нагрузки из-за возникновения стенокардии.
Приступы возникают в покое.
Стенокардия возникает только при физической нагрузке высокой интенсивности и продолжительности
Таблица ПА3-2. Предтестовая вероятность (ПТВ) диагноза ИБС в зависимости от пола, возраста и характера боли в грудной клетке [19, 20]
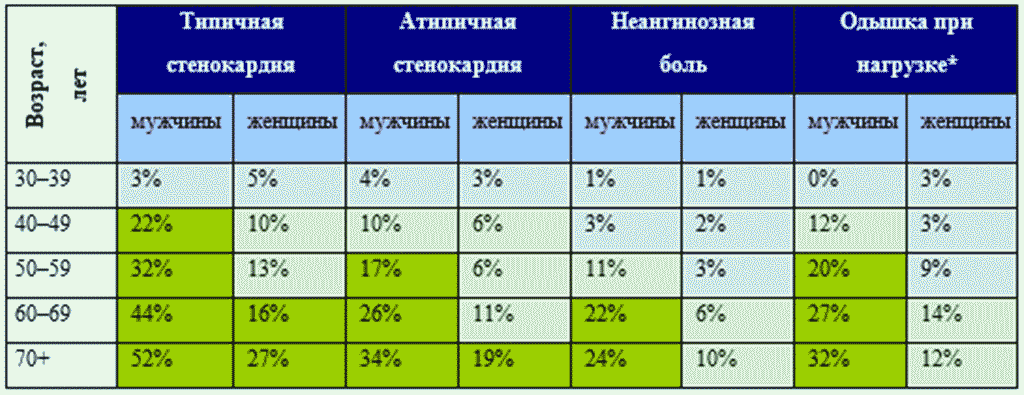
Примечание: * - группа включает пациентов, имеющих только одышку или одышку как основной клинический симптом; темно-зеленым цветом выделены ячейки, где проведение нагрузочных тестов наиболее эффективно (ПТВ > 15%), тут ежегодный риск сердечно-сосудистой смерти или острого инфаркта миокарда >= 3%; светло-зеленые ячейки обозначают ПТВ ИБС 5 - 15%, здесь нагрузочное тестирование может обсуждаться после оценки общей клинической вероятности наличия ИБС на основе выявления модификаторов риска
Таблица ПА3-3. Стадии хронического болезни почек и клинический план действий
Стадии
Описание
СКФ (мл/мин/1.73м2)
Действия <*>
1
Повреждение почек с нормальной или повышенной СКФ
>= 90
Диагноз и лечение; лечение сопутствующих заболеваний; замедление прогрессии заболевания; снижение риска ССЗ
2
Повреждение почек с легким снижением СКФ
60 - 89
Оценка скорости прогрессии
3А
Умеренное снижение СКФ
45 - 59
Исследование и лечение осложнений
3Б
Выраженное снижение СКФ
30 - 44
4
Тяжелое снижение СКФ
15 - 29
Подготовка к заместительной терапии
5
Терминальная почечная недостаточность
< 15
(или диализ)
Заместительная терапия (при наличии уремии)
--------------------------------
Примечание: СКФ - скорость клубочковой фильтрации. Определение хронической болезни почек: признаки повреждения почек или СКФ < 60 мл/мин/1.73 м в течение 3 месяцев и более.
<*> Включает также действия на предшествующих стадиях болезни
Таблица ПА3-4. Критерии риска ССО по данным диагностических тестов
Метод диагностики
Риск
Критерий соответствия
Клиническая и первичная инструментальная оценка
Симптомы
низкий риск
ПТВ ИБС < 5% и ПТВ ИБС 5 - 15%
умеренный риск
ПТВ ИБС > 15%
высокий риск
ПТВ ИБС > 15% + факторы, повышающие ПТВ
Симптомы + ФВ ЛЖ
высокий риск
Симптомы + ФВ ЛЖ< 35%
Стресс-ЭКГ
низкий риск <*>
Сердечно-сосудистая смертность < 1% в год
умеренный риск
Сердечно-сосудистая смертность 1 - 3% в год
высокий риск
Сердечно-сосудистая смертность > 3% в год
Неинвазивные специфические диагностические тесты
Стресс-ЭхоКГ
низкий риск
- НЛС нет или < 2 сегментов, коронарный резерв в ПНА >= 2,0 [68]
умеренный риск
- 2 и более сегмента ЛЖ с новыми НЛС
высокий риск
- 3 и более сегмента ЛЖ с новыми НЛС (акинезией или гипокинезией); коронарный резерв в передней нисходящей артерии < 2,0;
Стресс-ОФЭКТ/стресс-ПЭТ
низкий риск
- площадь ишемии < 1% миокарда ЛЖ
умеренный риск
- площадь ишемии 1 - 10% миокарда ЛЖ
высокий риск
- площадь ишемии > 10% миокарда ЛЖ
Стресс-МРТ
низкий риск
- нет ишемии, нет дисфункции
умеренный риск
- какая-либо ишемия и/или дисфункция
высокий риск
- >= 2 из 16 сегментов ЛЖ с дефектами перфузии на пике стресс-теста или >= 3 из 16 сегментов ЛЖ с индуцируемой добутамином дисфункцией
МСКТ - ангиография КА
низкий риск
- стенозы <= 50%
умеренный риск
- стеноз > 50% (кроме ствола ЛКА, проксимальной трети ПНА, трехсосудистого поражения с проксимальными стенозами)
высокий риск
- стеноз ствола ЛКА > 50%; стеноз проксимальной трети ПНА > 50%%; трехсосудистое поражение с проксимальными стенозами > 50%
Инвазивные специфические тесты
КАГ
низкий риск
- стенозы <= 50%
умеренный риск
- стенозы 50 - 90%
высокий риск
- стенозы > 90%
ФРК/МРК
высокий риск
- стеноз 50 - 90% и ФРК/МРК <= 0,80/<= 0,89
--------------------------------
Примечание: <*> - согласно риску, рассчитанному по шкале Дьюка, исходя из глубины депрессии сегмента ST, METs и возникновению приступа стенокардии (http://www.cardiology.org/tools/medcalc/duke/results.asp), ФВ ЛЖ - фракция выброса левого желудочка, НЛС - нарушения локальной сократимости, ПНА - передняя нисходящая коронарная артерия, ПТВ - предтестовая вероятность ИБС.
Таблица ПА3-5. Терапия стабильной ИБС в зависимости от клинической ситуации

Примечание: БАБ - бета-адреноблокаторы; ДГП-БКК - дигидропиридиновые блокаторы "медленных" кальциевых каналов; не-ДГП-БКК - недигидропиридиновые блокаторы кальциевых каналов; НДД - органические нитраты длительного действия.
Предложенный пошаговый алгоритм должен быть адаптирован для каждого пациента индивидуально. Учитывая ограниченные доказательства в отношении множества возможных комбинаций у разных пациентов, предложенный алгоритм является лишь опцией и не является строгой рекомендаций к выполнению.
Таблица ПА3-6. Факторы риска инсульта и системных эмболий у больных ФП и их значимость в баллах (шкала CHA2DS2-VASc)
Факторы риска
Баллы
"C" Хроническая сердечная недостаточность/дисфункция левого желудочка
1
"H" Артериальная гипертония
1
"A" Возраст >=75 лет
2
"D" Диабет
1
"S" Ишемический инсульт/транзиторная ишемическая атака/системные эмболии в анамнезе
2
"VASc" Сосудистое заболевание (инфаркт миокарда в анамнезе, атеросклероз периферических артерий нижних конечностей, атеросклеротическая бляшка в аорте)
1
Возраст 65 - 74 года
1
Женский пол
1
Таблица ПА3-7. Шкала оценки риска кровотечений HAS-BLEED
Буква <*>
Клиническая характеристика
Число баллов
H
Гипертония
1
A
Нарушение функции печени или почек (по 1 баллу)
1 или 2
S
Инсульт
1
B
Кровотечение
1
L
Лабильное МНО
1
E
Возраст > 65 лет
1
D
Лекарства или алкоголь (по 1 баллу)
1 или 2
<*> Первые буквы английских названий: "H" - систолическое АД > 160 мм рт. ст.; "A" - нарушение функции почек или печени: диализ, трансплантация почки или сывороточный креатинин >= 200 ммоль/л; хроническое заболевание печени (например, цирроз) или биохимические признаки серьезного поражения печени (например, уровень билирубина по крайней мере в 2 раза выше верхней границы нормы в сочетании с повышением активности АСТ/АЛТ/щелочной фосфатазы более чем в 3 раза по сравнению с верхней границей нормы и т.д.); "S" - инсульт в анамнезе; "B" - кровотечение в анамнезе и/или предрасположенность к кровотечению, например, геморрагический диатез, анемия и т.д.; "L" - нестабильное/высокое МНО или < 60% измерений МНО в пределах целевого диапазона, "E" - возраст старше 65 лет; "D" - лекарства (антитромбоцитарные, нестероидные противовоспалительные средства)/алкоголь.
Таблица ПА3-8. Факторы риска кровотечений у больных фибрилляцией предсердий, получающих антикоагулянты
Модифицируемые факторы риска
Артериальная гипертония (особенно, если САД > 160 мм рт. ст.)
Лабильное МНО или время пребывания МНО в целевом диапазоне менее 60% (для принимающих антагонисты витамина К (АВК))
Сопутствующий прием препаратов, повышающих риск кровотечения (антитромбоцитарные или НПВС)
Злоупотребление алкоголем (>= 8 порций в неделю) (количество порций = произведение объема напитка в литрах, его крепости и удельного веса, равного 0,789)
Частично модифицируемые факторы риска
Анемия
Нарушенная функция почек
Нарушенная функция печени
Снижение числа тромбоцитов или нарушение их функции
Немодифицируемые факторы риска
Возраст (> 65 лет), (>= 75 лет) <*>
Большое кровотечение в анамнезе
Инсульт в анамнезе
Почечная патология, требующая диализа, либо трансплантация почки
Цирроз печени
Злокачественное новообразование
Генетические факторы
Биомаркеры - факторы риска кровотечений
Высокочувствительный тропонин
Фактор роста и дифференцировки 15
Уровень креатинина сыворотки/расчетное значение клиренса креатинина
Таблица ПА3-9. Рекомендации по типу реваскуляризации (КШ или ЧКВ) у пациентов со стабильной ИБС с коронарной анатомией, подходящей обоим методам, и низкой прогнозируемой хирургической смертностью.
Локализация и тяжесть поражения коронарного русла
КШ
(УДД,
ЧКВ
(УДД,
Ссылка
Класс
Уровень
УУР)
Класс
Уровень
УУР)
Одно- или двухсосудистое поражение в отсутствие проксимального стеноза ПНА
IIb
C
3C
I
C
1C
[124, 162 - 168]
Однососудистое поражение с проксимальным стенозом ПНА
I
A
1A
I
A
1A
[124, 162 - 168]
Двухсосудистое поражение с проксимальным стенозом ПНА
I
B
2B
I
C
2C
[124, 126, 129]
Поражение ствола ЛКА с низким баллом по шкале SYNTAX (0 - 22)
I
A
1A
I
A
1A
[125, 169, 170]
Поражение ствола ЛКА со средним баллом по шкале SYNTAX (23 - 32)
I
A
1A
IIa
A
2A
[125, 169, 170]
Поражение ствола ЛКА с высоким баллом по шкале SYNTAX (>= 33)
I
A
1A
III
B
4A
[125, 169, 170]
Трехсосудистое поражение с низким баллом по шкале SYNTAX (<= 22)
I
A
2 A
I
A
2A
[171 - 174]
Трехсосудистое поражение со средним и высоким баллом по шкале SYNTAX (>= 23)
I
A
2A
III
A
4A
[171 - 174]
Трехсосудистое поражение при сахарном диабете c низким баллом по шкале SYNTAX (<= 22)
I
A
1A
IIb
A
3
[175 - 180]
Трехсосудистое поражение при сахарном диабете со средним и высоким баллом по шкале SYNTAX (>= 23)
I
A
1A
III
A
5A
[175 - 180]
Рисунок ПА31. Алгоритм выбора режима антитромботической терапии у больных ФП после планового чрескожного коронарного вмешательства
Сокращения: ЧКВ - чрескожное коронарное вмешательство, ОАК - оральные антикоагулянты, АСК** - ацетилсалициловая кислота**.
Приложение Б
АЛГОРИТМЫ ВЕДЕНИЯ ПАЦИЕНТА
Приложение В
ИНФОРМАЦИЯ ДЛЯ ПАЦИЕНТОВ
Краткая информация о заболевании
У Вас выявлена одна из форм ишемической болезни сердца (ИБС). Приведенная ниже информация очень важна, поскольку поможет Вам правильно выполнять врачебные рекомендации, которые улучшат Ваше самочувствие, повысят работоспособность и снизят риск тяжелых осложнений. В дальнейшем Вы сможете самостоятельно принимать многие важные решения, касающиеся Вашего здоровья. Пожалуйста, внимательно ознакомьтесь с предлагаемой информацией и обсудите непонятные вопросы с Вашим лечащим врачом.
Главная причина ИБС - постепенное сужение одного или нескольких сердечных сосудов атеросклеротическими бляшками. Основным компонентом атеросклеротической бляшки является холестерин. Постепенно сужая просвет(ы) сосудов сердца, атеросклеротические бляшки приводят к нехватке кровотока в различных участках постоянно работающей сердечной мышцы. Обычно на ранних стадиях этого долгого процесса болезнь не проявляется никакими симптомами, в промежуточной стадии - проявляется болью в груди при физических нагрузках и в покое, в поздней стадии, когда сердечный сосуд закрывается полностью, может развиться инфаркт миокарда. Инфаркт - тяжелое и опасное для жизни осложнение ИБС, однако его можно предотвратить. Для этого успешно применяются многие лекарственные средства и различные способы хирургического лечения. Предотвращение инфаркта - очень важная задача, поскольку любой инфаркт может быть фатальным, каждый повторный инфаркт протекает тяжелее предыдущего и в дальнейшем приводит к более тяжелой инвалидизации.
Внимательное наблюдение за своим состоянием, аккуратное и точное соблюдение врачебных предписаний, своевременный контакт с врачом позволяют пациентам с ИБС надолго отсрочить развитие инфаркта миокарда, устранить или облегчить симптомы болезни, повысить уровень активности в повседневной жизни.
Важнейший базовый принцип лечения ИБС - придерживаться здорового образа жизни. Это позволит устранить многие факторы риска и снизить риск тяжелых осложнений.
Дополнительно к изменению образа жизни Вам придется принимать медикаментозные средства. Некоторые препараты нужно принимать постоянно, другие - только при ухудшении самочувствия. Пожалуйста, обсудите с Вашим врачом каждый рекомендованный препарат, сообщите ему обо всех известных Ваших аллергических реакциях на лечение, если они отмечались ранее.
Главные мероприятия по здоровому образу жизни:
- Отказ от курения.
- Снижение избыточного веса.
- Повышение уровня физической активности с учетом Вашего возраста, состояния здоровья и наличия других сопутствующих заболеваний. Для выбора оптимального уровня физической нагрузки желательна консультация врача-специалиста.
- Постоянное соблюдение низкожировой диеты, ограничение или полный отказ от алкоголя.
- Регулярный самоконтроль артериального давления, частоты пульса.
- Регулярный контроль уровня холестерина липопротеидов низкой плотности в крови (не реже 1 раза в 6 месяцев).
- Регулярное посещение врача для оценки состояния и необходимой коррекции лечения.
- Лечение сопутствующих заболеваний
Некоторые сопутствующие заболевания могут провоцировать обострение, ухудшать симптомы или затруднять лечение ИБС. Поэтому сообщите врачу о всех известных Вам сопутствующих заболеваниях. Особенно важны:
- Перенесенный ранее инфаркт миокарда. Любые операции на сердце.
- Артериальная гипертония.
- Сахарный диабет и другие эндокринные болезни.
- Сердечная недостаточность.
- Анемия и другие болезни крови.
- Язвенная болезнь желудка и двенадцатиперстной кишки.
Главные принципы лекарственной терапии
Одного препарата для лечения ИБС не существует. Лекарственные средства при этой болезни всегда назначаются комплексно.
Правильно подобранные лекарственные средства действуют на различные механизмы болезни, дополняют друг друга и, как правило, хорошо переносятся при длительном приеме.
Прерывистое или курсовое лечение ИБС не проводится. Лечение этого заболевания является поддерживающим и при хорошей переносимости проводится неопределенно долго. Если на фоне лечения Вы почувствовали себя хуже или появились симптомы побочных эффектов - обязательно обратитесь к врачу для поиска причины ухудшения и возможной замены одного или нескольких препаратов. Изменять схему лечения должен только врач. Не отменяйте самостоятельно ни один из препаратов на долгое время - это может быть опасным для Вашего здоровья.
Обязательно сообщите врачу о всех препаратах, которые Вы принимаете по поводу других заболеваний. Это поможет избежать побочных эффектов и ненужного дублирования лечения.
Всегда смотрите на сроки годности препаратов, указанные производителями на упаковках. Своевременно заменяйте в Вашей аптечке препараты с истекающим сроком годности на новые.
Медицинская документация
Храните дома все выписки из стационаров, электрокардиограммы, копии лабораторных анализов и протоколов инструментальных исследований (если они проводились). Во время планового визита в поликлинику, при госпитализации, при вызове "скорой помощи" обязательно покажите эти документы врачу. Сравнение Ваших данных с предыдущими показателями очень важно и может иметь решающее значение для правильного диагноза и лечения.
Для экстренной помощи:
- Всегда имейте при себе нитроглицерин в таблетках или в аэрозольной упаковке.
- Запишите и храните в доступном месте телефоны "скорой помощи, ближайшей поликлиники, Вашего врача (при возможности). Полезно также знать адреса и телефоны приемных отделений ближайших больниц.
Во время приступа стенокардии
Стенокардией называют боль в груди, вызванную заболеванием сердечных сосудов. В большинстве случаев такая боль возникает в центре груди, "под ложечкой" или в области шеи, может сопровождаться нехваткой воздуха. Иногда боль при стенокардии отдает в спину, левое плечо или левую руку. Как правило, боль при стенокардии давящая, жгучая, распирающая. Может сопровождаться потливостью. Не связана с дыханием и не зависит от изменения положения тела. В большинстве случаев стенокардия возникает при нагрузке (ходьба или физический труд), но может появляться и в покое, а также при воздействии холода (мороз, сильный ветер, купание в открытых водоемах).
Возникновение приступа стенокардии в покое или ночью - тревожный признак. В таких случаях следует немедленно принять нитроглицерин, и при неэффективности - сразу вызвать "скорую помощь", чтобы не допустить развития инфаркта миокарда.
Предотвращение приступов стенокардии
Чтобы предотвратить приступы стенокардии Вам следует регулярно принимать рекомендованные препараты в предписанных дозах. В некоторых случаях можно дополнительно принимать нитроглицерин непосредственно перед ожидаемыми физическими или эмоциональными нагрузками (продолжительная ходьба, физическая работа, сексуальная активность). Если приступы стенокардии в повседневной жизни участились, появились отсутствовавшие ранее приступы в покое и по ночам, если Вы стали чаще принимать нитроглицерин - срочно обращайтесь к врачу. Возможно, Вам потребуется срочное изменение лечения или госпитализация для дообследования.
Амбулаторное наблюдение
Даже при удовлетворительном самочувствии старайтесь не реже 1 раза в год посещать врача для общего осмотра, записи контрольной ЭКГ и оценки результатов анализа крови. Если Вы недавно перенесли инфаркт миокарда, посещать врача нужно чаще. Очень полезно вести дневник своего самочувствия с указанием артериального давления, частоты пульса и принимаемых лекарственных средств. При визите покажите этот дневник врачу. При необходимости врач может назначить Вам дополнительные инструментальные и лабораторные исследования. Если Ваше состояние ухудшается и эффективность лечения снижается - обращайтесь к врачу за помощью чаще. Не занимайтесь самолечением: Вы можете нанести непоправимый вред своему здоровью.
Направление на хирургическое лечение
При правильно подобранном лечении, аккуратном выполнении врачебных рекомендаций по диете и образу жизни ИБС может долго протекать в стабильной форме, и Ваша трудоспособность не будет существенным образом ограничена. В тех случаях, когда заболевание прогрессирует, приступы стенокардии или симптомы сердечной недостаточности нарастают, и медикаментозная терапия становится малоэффективной, врач может предложить Вам хирургическое лечение. Современные способы хирургического лечения (шунтирование или стентирование коронарных сосудов) способны значительно улучшить состояние больных, существенно снизить риск тяжелых осложнений, в том числе риск смертельного исхода, а в некоторых случаях снизить потребность в лекарственных препаратах. Чтобы выбрать наилучший способ хирургического лечения, пациенту всегда проводят предварительное исследование в стационаре. Решение о хирургическом лечении всегда принимают врачи-специалисты, с обязательным учетом мнения пациента.
Приложение Г
МОДИФИЦИРОВАННЫЙ ОПРОСНИК РОУЗА ДЛЯ ВЫЯВЛЕНИЯ СТЕНОКАРДИИ
Если в этом опроснике Вы хотя бы два раза выбрали ответы, выделенные жирным курсивом, Вам необходимо записаться на прием к кардиологу для уточнения причины болей в груди или ухудшения течения Вашего заболевания и назначения соответствующего лечения.
1. Бывает ли у Вас боль или неприятное ощущение в грудной клетке?
- Нет.
- Да.
2. Возникает ли эта боль, когда Вы идете в гору, поднимаетесь по лестнице или спешите?
- Нет.
- Да.
- Никогда не хожу быстро и не поднимаюсь в гору.
3. Возникает ли эта боль при ходьбе обычным шагом по ровному месту?
- Нет.
- Да.
4. Что Вы делаете, если боль (неприятное ощущение) возникает во время ходьбы?
- Останавливаюсь или иду медленнее.
- Продолжаю идти, не снижая темпа.
- Принимаю нитроглицерин или другие препараты.
5. Если Вы останавливаетесь или принимаете нитроглицерин, что происходит с болью?
- Боль исчезает или уменьшается.
- Боль не исчезает.
6. Как быстро проходит боль?
- Через 10 - 15 минут или быстрее.
- Более чем через 10 минут.
7. Можете ли Вы сказать, где ее ощущаете?
- Грудина (верхняя или средняя треть).
- Грудина (нижняя треть).
- Левая сторона грудной клетки спереди.
- Левая рука.
- Другие области.
8. Вы обращались по поводу этих болей к врачу?
- Нет.
- Да.
9. Когда впервые появились эти боли?
- Менее 4 недель назад.
- Более 1 месяца назад.
10. Как часто они возникают в течение последнего месяца?
- Менее 2 раз в неделю.
- Почти каждый день.
11. Изменился ли их характер в течение последнего месяца?
- Нет.
- Да.
