"Клинические рекомендации "Рак шейки матки"
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ
РАК ШЕЙКИ МАТКИ
МКБ 10: C53
Год утверждения (частота пересмотра): 2018 (пересмотр каждые 3 года)
ID: КР537
URL
Профессиональные ассоциации
- Ассоциация онкологов России Российское общество клинической онкологии
Ключевые слова
- Рак шейки матки
- Хирургия
- Лучевая терапия
- Химиотерапия
Список сокращений
ВПЧ - вирус папилломы человека
РШМ - рак шейки матки
МКБ-10 - Международная классификация 10 пересмотра
ВОЗ - Всемирная Организация Здравоохранения
КТ - компьютерная томография
МРТ - магниторезонансная томография
УЗИ - ультразвуковое исследование
ЭКГ - электрокардиография
ПЭТ - позитронно-эмиссионная томография
ПЭТ-КТ - позитронно-эмиссионная томография, совмещенная с КТ
ЛТ - лучевая терапия
ХТ - химиотерапия
Термины и определения
Рак шейки матки (РШМ) - злокачественная опухоль, исходящая из слизистой оболочки шейки матки (эктоцервикса или цервикального канала)
Операция I типа - экстрафасциальная экстирпация матки (по классификации M. Piver, 1974)
Операция II типа - модифицированная расширенная экстирпация матки (подразумевает удаление медиальной половины кардинальных и крестцово-маточных связок и тазовую лимфодиссекцию; мочеточник туннелируется, но не мобилизуется по нижнелатеральной полуокружности) (по классификации M. Piver, 1974)
Операция III типа - расширенная экстирпация матки по Мейгсу (подразумевает удаление кардинальных и крестцово-маточных связок от стенок таза, верхней трети влагалища и тазовую лимфодиссекцию) (по классификации M. Piver, 1974)
Расширенная трахелэктомия - хирургическое вмешательство, включающее удаление шейки матки с параметральной клетчаткой и верхней третью влагалища, двустороннюю тазовую лимфаденэктомию и наложение анастомоза между телом матки и влагалищем.
1. Краткая информация
1.1 Определение
Рак шейки матки (РШМ) - злокачественная опухоль, исходящая из слизистой оболочки шейки матки (эктоцервикса или цервикального канала).
1.2 Этиология и патогенез
РШМ имеет спорадический характер. Развитие этого заболевания не связано с наличием известных наследственных синдромов. Причиной развития РШМ является ВПЧ [1, 2]. Онкогенные подтипы ВПЧ 16/18 обнаруживаются у большинства больных РШМ. В странах с высоким уровнем заболеваемости РШМ, персистирующий ВПЧ встречается у 10 - 20% женщин, в то время как в странах с низким уровнем заболеваемости - только у 5 - 10% [3]. В качестве факторов риска развития данной патологии рассматриваются: раннее начало половой жизни и ранние первые роды, частая смена половых партнеров, отказ от контрацептивов "барьерного" типа, курение, применение оральных контрацептивов, иммуносупрессия [4, 5]. Дискутируется вопрос о влиянии различных инфекций, передаваемых половым путем.
1.3 Эпидемиология
Ежегодно в мире регистрируется 528 тысяч новых больных раком шейки матки (РШМ) и 266 тысяч смертей от этого заболевания. Широкое распространение этого заболевания отмечено в развивающихся странах, на которые приходится 78% наблюдений [7]. В 2012 г. в России было зарегистрировано 15 427 новых случаев РШМ, т.е. на долю этой патологии в структуре заболеваемости женщин злокачественными новообразованиями пришлось 5,3% (5 место). По отношению к 2007 г. прирост абсолютного числа заболевших составил 12,2%. В возрастной группе 15 - 39 лет заболеваемость РШМ была максимальной (22,3%) по сравнению с другими возрастными группами [6].
В структуре смертности от онкологических заболеваний в России в 2012 году среди женщин РШМ составил 4,7%, что соответствует 8-му месту. Летальность на первом году с момента установления диагноза составила 17%. В возрастной группе 15 - 39 лет смертность от РШМ также была максимальной (21,1%) по сравнению с другими возрастными группами [6].
1.4 Кодирование по МКБ 10
C53 Злокачественное новообразование шейки матки
C53.0 Внутренней части
C53.1 Наружной части
C53.8 Поражение шейки матки, выходящее за пределы одной и более вышеуказанных локализаций
C53.9 Шейки матки неуточненной части
1.5 Классификация
1.5.1 Международная гистологическая классификация (классификация ВОЗ, 4-е издание, 2014 г.) [8]:
- Опухоли из плоского эпителия:
- Плоскоклеточные интраэпителиальные поражения (поражение плоского эпителия (SIL)):
- 8077/0 поражение плоского эпителия легкой степени (LSIL))
- 8077/2 поражение плоского эпителия тяжелой степени (HSIL))
- 8070/3 Плоскоклеточный рак
- 8071/3 ороговевающий;
- 8072/3 неороговевающий;
- 8052/3 папиллярный;
- 8083/3 базалоидный;
- 8051/3 кондиломатозный;
- 8051/3 веррукозный;
- 8120/3 плоскоклеточно-переходноклеточный;
- 8082/3 лимфоэпителиальный;
- Опухоли из железистого эпителия:
- 8140/2 Аденокарцинома in situ;
- 8140/3 Аденокарцинома:
- 8140/3 Эндоцервикальная аденокарцинома, обычный типа;
- 8480/3 Муцинозная:
- 8482/3 желудочного типа;
- 8144/3 кишечного типа;
- 8490/3 перстневидноклеточного типа;
- 8263/3 Виллогландулярная;
- 8380/3 Эндометриоидная;
- 8310/3 Светлоклеточная;
- 8441/3 Серозная;
- 9110/3 Мезонефральная;
- 8574/3 Аденокарцинома смешанная с нейроэндокринной карциномой;
- Другие эпителиальные опухоли:
- 8560/3 Железисто-плоскоклеточный рак;
- 8015/3 стекловидноклеточный рак;
- 8096/3 Аденобазальный рак;
- 8200/3 Аденокистозный рак;
- 8020/3 Недифференцированный рак
- Нейроэндокринные опухоли:
- Нейроэндокринные опухоли низкой степени злокачественности
- 8240/3 карциноид;
- 8249/3 атипичный карциноид;
- Нейроэндокринные опухоли высокой степени злокачественности
- 8041/3 мелкоклеточный нейроэндокринный рак;
- 8013/3 крупноклеточный нейроэндокринный рак;
Выделяю три степени дифференцировки РШМ:
G1 - высокодифференцированная
G2 - умереннодифференцированная
G3 - низкодифференцированная или недифференцированная
Gx - невозможно определить степень дифференцировки
1.6 Стадирование
Диагноз РШМ устанавливается только на основании результатов гистологического исследования.
РШМ стадируется клинически. Клиническая стадия РШМ устанавливается до начала специальной терапии, что необходимо для выбора метода и составления плана лечения. Клиническая стадия не изменяется вне зависимости от последующих находок. В случаях, когда есть затруднения в точном определении стадии, следует устанавливать более раннюю. Морфологические находки у больных, подвергнутых хирургическому лечению, не изменяют клиническую стадию. Они должны быть отмечены отдельно. Для этой цели подходит номенклатура TNM. Стадирование производится на основании классификации FIGO (2009 г.) и TNM (7-е издание, 2009 г.) [9]
Таблица 1. Классификация РШМ по стадиям (FIGO) и распространенности опухолевого процесса (TNM).
TNM
FIGO
TX
Недостаточно данных для оценки первичной опухоли
T0
Первичная опухоль не определяется
Tis <а>
Рак insitu, преинвазивный рак (эти случаи не входят в статистику заболеваемости раком шейки матки)
T1
Стадия I <б>
Опухоль ограничена маткой (распространение на тело матки не учитывается)
T1a
IA
Диагноз ставится только при гистологическом исследовании
T1a1
IA1
Глубина инвазии не более 3 мм (микроинвазивный рак). Горизонтальное распространение не должно превышать 7 мм, в противном случае опухоль следует относить к стадии IB
T1a2
IA2
Глубина инвазии более 3 мм, но не более 5 мм (измеряется от базальной мембраны поверхностного или железистого эпителия). Горизонтальное распространение не должно превышать 7 мм, в противном случае опухоль следует относить к стадии IB
T1b
IB
Глубина инвазии более 5 мм
T1b1
IB1
Размеры опухоли не более 4 см
T1b2
IB2
Размеры опухоли более 4 см
T2
Стадия II <в>
Опухоль, распространившаяся за пределы матки, без перехода на стенки таза и поражения нижней трети влагалища
T2a
IIA
Без вовлечения параметрия
T2a1
IIA1
Размеры опухоли не более 4 см
T2a2
IIA2
Размеры опухоли более 4 см
T2b
IIB
С вовлечением параметрия
T3
Стадия III <г>
Опухоль, вовлекающая стенки таза (при ректальном исследовании отсутствует пространство между опухолью и стенкой таза) или нижнюю треть влагалища, а также все случаи рака шейки матки с гидронефрозом и нефункционирующей почкой
T3a
IIIA
Вовлечение нижней трети влагалища
T3b
IIIB
Распространение на стенку таза или гидронефроз и нефункционирующая почка
Стадия IV
Опухоль, распространившаяся за пределы таза или прорастающая слизистую мочевого пузыря или прямой кишки (буллезный отек не позволяет отнести опухоль к стадии IV)
T4
IVA <д>
Прорастание мочевого пузыря или прямой кишки
M1
IVB
Отдаленные метастазы
Состояние регионарных лимфатических узлов
Отдаленные метастазы
NX
Недостаточно данных для оценки
M0
Отдаленные метастазы отсутствуют
N0
Признаков поражения регионарных лимфатических узлов нет
M1 <е>
Имеются отдаленные метастазы
N1
Метастазы в регионарных лимфатических узлах
<а> В классификации FIGO стадию 0 (Tis) не применяют.
<б> Стадии IA1 и IA2 диагностируют на основании результатов гистологического исследования операционных препаратов преимущественно после конизации шейки матки. При конизации должна быть удалена вся измененная влагалищная часть шейки матки. Если опухоль определяется макроскопически, то следует относить ее к стадии T1b. Глубина инвазии определяется от базальной мембраны, независимо от того, исходит опухоль из поверхностного эпителия или из железистого. Выявление опухолевых эмболов в сосудах не меняет стадию, но должно быть отражено в заключении гистологического исследования, поскольку может повлиять на тактику лечения. Распространение на тело матки не учитывается, поскольку переход опухоли на тело матки до операции выявить очень трудно.
<в> При вовлечении параметрия стадия III диагностируется тогда, когда инфильтрат в параметрии имеет узловую форму и доходит до стенки таза. В остальных случаях диагностируется стадия IIb. Следует подчеркнуть, что при гинекологическом исследовании судить о природе инфильтрата (воспалительный или опухолевый) невозможно.
<г> При гидронефрозе и нефункционирующей почке, обусловленных сдавлением мочеточника опухолью, диагностируют стадию III.
<д> Инвазия в слизистую оболочку мочевого пузыря или прямой кишки должна быть подтверждена результатами биопсии.
<е> Включая метастазы в паховых, поясничных лимфатических узлах, а также на брюшине, за исключением серозных оболочек органов малого таза. Исключены метастазы во влагалище, серозные оболочки малого таза и придатки.
2. Диагностика
2.1 Жалобы и анамнез
- Рекомендуется тщательный сбор жалоб и анамнеза у пациентки с целью выявления факторов, которые могут повлиять на выбор тактики лечения.
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - IIb)
Комментарии: Дисплазия и преинвазивный РШМ не имеют патогномоничных клинических проявлений и диагностируются только морфологически. Преинвазивный РШМ может быть выявлен при гистологическом исследовании на визуально неизменной шейке матки на фоне дисплазии.
Ранними клиническими проявлениями РШМ являются обильные водянистые бели и "контактные" кровянистые выделения из половых путей. У женщин репродуктивного периода жизни возможно появление ациклических кровянистых выделений из половых путей, в постменопаузе - периодических или постоянных. При значительном местно-регионарном распространении опухоли пациентки жалуются на боли, дизурию и затруднения при дефекации. При присоединении бактериальной инфекции выделения из половых путей мутные, с неприятным запахом. В запущенных случаях образуются ректовагинальные и мочепузырно-вагинальные свищи, могут пальпироваться метастатически измененные паховые и надключичные лимфатические узлы, возможно появление отека одной из нижних конечностей.
2.2 Физикальное обследование
- Рекомендуется тщательный физикальный осмотр, включающий гинекологический осмотр и ректовагинальное исследование.
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - IV)
2.3 Лабораторная диагностика
- Рекомендуется выполнять: развернутые клинический и биохимический анализы крови с показателями функции печени, почек, анализ крови на онкомаркер SCC (при плоскоклеточном раке), исследование свертывающей системы крови, общий анализ мочи.
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - IV)
2.4 Инструментальная диагностика
- Рекомендуется выполнить биопсию всех подозрительных участков шейки матки, выскабливание цервикального канала, при необходимости - конизацию [10].
Уровень убедительности рекомендаций A (уровень достоверности доказательств Ib)
Комментарий: диагноз РШМ устанавливается только на основании результатов гистологического исследования. Цитологической верификации недостаточно для установления диагноза РШМ.
- Рекомендуется выполнить расширенную кольпоскопию [10].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - IV)
Комментарий: расширенная кольпоскопия помогает определить наиболее измененный участок шейки матки для выполнения прицельной биопсии при отсутствии экзофитного компонента опухоли.
- Рекомендуется выполнить цистоскопию [10].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - IV)
Комментарий: рекомендуется у больных с размерами опухоли шейки матки более 4 см, при переходе опухоли на передний свод влагалища или при наличии жалоб.
- Рекомендуется выполнить ректороманоскопию [10].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - IV)
Комментарий: рекомендуется у больных с размерами опухоли шейки матки более 4 см, при переходе опухоли на задний свод влагалища или при наличии жалоб.
- Рекомендуется выполнить УЗИ, брюшной полости, забрюшинного пространства, малого таза и шейно-надключичной области [10].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - IV)
Комментарий: УЗИ - наиболее простой и доступный метод визуализации образований в брюшной полости, забрюшинном пространстве и полости таза.
- Рекомендуется выполнить рентгенографию грудной клетки [10].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - IV)
- Рекомендуется выполнить МРТ малого таза с внутривенным контрастированием [10].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - IIb)
Комментарий: МРТ информативнее КТ при оценке глубины инвазии и перехода опухоли на параметрий и смежные органы; точность определения глубины инвазии с помощью МРТ составляет 71 - 97% [11, 12].
- Рекомендуется выполнить КТ малого таза и забрюшинного пространства с внутривенным контрастированием при невозможности выполнить МРТ.
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - IIb)
Комментарий: МРТ информативнее КТ при оценке глубины инвазии и перехода опухоли на параметрий и смежные органы; точность определения глубины инвазии с помощью МРТ составляет 71 - 97%. Для выявлении метастазов в лимфатических узлах информативность КТ и МРТ одинакова [11, 12].
- Рекомендуется выполнить ПЭТ или ПЭТ-КТ [10].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - IIb)
Комментарий: ПЭТ или ПЭТ-КТ наиболее информативна для выявления метастатического поражения лимфатических узлов и выявления отдаленных метастазов [13].
- Рекомендуется выполнить ЭКГ.
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - IV)
- Рекомендуется выполнить рентгенографию костей скелета или остеосцинтиграфию при подозрении на метастатическое поражение костей скелета [10].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - IV)
- Рекомендуется выполнить МРТ или КТ головного мозга с внутривенным контрастированием при подозрении на метастатическое поражение головного мозга.
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - IV)
2.5 Иная диагностика
- Рекомендуется проводить гистологическое исследование хирургически удаленного опухолевого препарата, при этом в морфологическом заключении рекомендуется отразить следующие параметры:
1. Гистологический тип опухоли;
2. Степень дифференцировки опухоли
3. Размеры опухоли;
4. Глубина инвазии опухоли
5. Толщина шейки матки в месте наибольшей инвазии опухоли
6. Опухолевые эмболы в кровеносных и лимфатических сосудах
7. Опухоль в крае резекции влагалища, параметриев, по границе резекции шейки матки (при выполнении конизации/ампутации или трахелэктомии)
8. Переход опухоли на влагалище
9. Опухолевое поражение параметрия справа, слева
10. Общее число удаленных и пораженных тазовых лимфоузлов справа, слева;
11. Общее число удаленных и пораженных лимфоузлов параметрия справа, слева
12. Общее число удаленных и пораженных поясничных лимфоузлов
13. Переход опухоли на тело матки
14. Метастатическое поражение яичников
15. Прорастание опухоли в стенку мочевого пузыря, прямой кишки (при выполнении экзентерации или резекции смежных органов)
16. Степень лечебного патоморфоза первичной опухоли и метастазов в лимфоузлах в случае предоперационной терапии.
Уровень убедительности рекомендаций A (уровень достоверности доказательств - Ib)
- Рекомендуется при подготовке к лечению по показаниям проводить дополнительное обследование: эхокардиографию, холтеровское мониторирование сердечной деятельности, исследование функции внешнего дыхания, УЗДГ сосудов шеи и нижних конечностей, забор мазков с шейки матки и из канала шейки матки, забор аспирата из полости матки, цервикогистероскопию, раздельное диагностическое выскабливание полости матки и цервикального канала, экскреторную урографию, магнитно-резонансную/компьютерную томографию брюшной полости с контрастным усилением, ирригоскопию, колоноскопию, диагностическую лапароскопию, ренографию, консультации специалистов (уролога, терапевта, эндокринолога, невролога и др.).
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - IV)
3. Лечение
3.1 Хирургическое лечение
- При тяжелой дисплазии (CIN III) и внутриэпителиальном РШМ (рак in situ) рекомендуется выполнять конизацию шейки матки с последующим выскабливанием оставшейся части цервикального канала и, по показаниям, полости матки.
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - IIa)
Комментарий: При гистологическом подтверждении диагноза и отсутствии опухолевых клеток в краях резекции и соскобе из оставшейся части цервикального канала приведенный объем хирургического вмешательства считается адекватным.
- При РШМ IA1 стадии (инвазия <= 3 мм и <= 7 мм в горизонтальном распространении) рекомендуется выполнять конизацию шейки матки с последующим выскабливанием оставшейся части цервикального канала и, по показаниям, полости матки [14]. При наличии сопутствующей гинекологической патологии или отсутствии необходимости сохранения репродуктивной функции у больных РШМ IA1 стадии возможно выполнение экстирпации матки (операция I типа) [10].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - IIa)
Комментарий: Если в краях резекции шейки матки или в соскобе из оставшейся части цервикального канала обнаруживаются дисплазия или клетки рака, риск остаточной опухоли достаточно высокий и, прежде чем определять дальнейшую тактику лечения, необходима повторная конизация. Это необходимо для уточнения степени поражения шейки матки и определения объема последующей операции. Если реконизация невозможна пациентку лечат как при IB1 стадии РШМ. Если при глубине инвазии опухоли в строму до 3 мм обнаруживаются раковые эмболы в кровеносных или лимфатических сосудах, возрастает риск метастатического поражения регионарных лимфатических узлов. В этом случае больной следует выполнить модифицированную расширенную экстирпацию матки (операция II типа)].
- При РШМ IA2 стадии (инвазия > 3 мм и <= 5 мм и <= 7 мм в горизонтальном распространении) рекомендовано выполнение модифицированной расширенной экстирпации матки (II тип) [15].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - IIa)
Комментарий: При противопоказаниях к хирургическому лечению может проводиться ЛТ.
- При необходимости сохранить детородную функцию у больной РШМ IA2 стадии возможно выполнить широкую конизацию шейки матки с экстраперитонеальной или лапароскопической тазовой лимфаденэктомией либо расширенную трахелэктомию (тип II) [10, 16, 17].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - IIa)
- У больных РШМ IB1 и IIA1 стадий (опухоль < 4 см) рекомендованы расширенная экстирпация матки (операция III типа) или ЛТ/химиолучевая терапия по радикальной программе [18, 29]. Выбор метода лечения зависит от наличия ресурсов, опыта врача, возраста пациентки и наличия сопутствующих заболеваний.
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - Ib)
Комментарий: Применение комбинации хирургического лечения с ЛТ достоверно увеличивает частоту осложнений. Поэтому при планировании лечения больных IB1 и IIA1 стадий РШМ следует избегать комбинации хирургического лечения и ЛТ [18].
- При наличии метастазов в тазовых лимфатических узлах у больных РШМ IB1 и IIA1 стадий (опухоль < 4 см) рекомендовано обязательное выполнение поясничной лимфодиссекции [19, 20].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - IIb)
- Адъювантное лечение у больных РШМ IB1 и IIA1 стадий (опухоль < 4 см) рекомендовано проводить в зависимости от наличия факторов риска прогрессирования [21, 22, 23, 24].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - Ib)
Комментарий:
Группа высокого риска прогрессирования: при наличии одного из факторов высокого риска прогрессирования после расширенной экстирпации матки (метастазы в лимфатических узлах, поражение параметрия или опухоль в краях резекции влагалища) показано проведение адъювантной химиолучевой терапии (ЛТ + еженедельное введение цисплатина в дозе 40 мг/м2 на протяжении лучевой терапии)). При метастазах в поясничных лимфатических узлах проводится облучение расширенным полем [27, 28].
Группа промежуточного риска прогрессирования: при отсутствии факторов высокого риска прогрессирования после расширенной экстирпации матки, но при наличии как минимум двух из трех факторов (инвазия опухоли более 1/3 толщины миометрия шейки матки; инвазия опухолью лимфатических и кровеносных сосудов; большой размер первичной опухоли (4 см)) показано проведение адъювантной ЛТ.
Группа низкого риска прогрессирования: при отсутствии факторов высокого риска прогрессирования после расширенной экстирпации матки, но при наличии одного из трех факторов (инвазия опухоли более 1/3 толщины миометрия шейки матки; инвазия опухолью лимфатических и кровеносных сосудов; большой размер первичной опухоли (4 см)) адъювантное лечение не показано.
- При необходимости сохранить детородную функцию у больных РШМ IB1 и IIA1 стадий (опухоль < 4 см) возможно выполнить расширенную трахелэктомию (тип III) [25, 26].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - IIa)
- При невозможности проведения хирургического лечения по медицинским показаниям или по выбору пациентки при РШМ IB1 и IIA1 стадий (опухоль < 4 см) возможно проведение ЛТ/химиолучевой терапии по радикальной программе [18].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - Ib)
Комментарий: ЛТ по радикальной программе должна проводиться не более 6 - 7 недель. Увеличение продолжительности ЛТ терапии снижает выживаемость больных [39, 40].
- Одним из трех возможных вариантов лечения больных IB2 и IIA2 стадий РШМ является расширенная экстирпация матки (операция III типа).
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - IIb)
Комментарий: При наличии метастазов в тазовых лимфатических узлах обязательно выполняется поясничная лимфодиссекция [19, 20]. Адъювантное лечение проводится по тем же принципам, что и при IB1 и IIA1 стадиях РШМ (см. выше) [21 - 24]. Больным с метастазами в поясничных лимфатических узлах проводится облучение расширенным полем [27, 28].
- Вторым из трех возможных вариантов лечения больных IB2 и IIA2 стадий РШМ является химиолучевое лечение по радикальной программе: сочетанная ЛТ + еженедельное введение цисплатина** в дозе 40 мг/м2 на протяжении лучевой терапии [30, 31, 32, 33, 34].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - Ia)
Комментарий: Проведение адъювантной гистерэктомии после химиолучевой терапии не рекомендовано.
- Третьим возможным вариантом лечения больных IB2 и IIA2 стадий РШМ является неоадъювантная химиотерапия (ХТ) на основе препаратов платины с последующей расширенной экстирпацией матки III типа [35, 36].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - Ia)
Комментарий: При наличии метастазов в тазовых лимфатических узлах обязательно выполняется поясничная лимфодиссекция [19, 20]. Адъювантное лечение проводится по тем же принципам, что и при IB1 и IIA1 стадиях РШМ (см. выше) [21 - 24]. Больным с метастазами в поясничных лимфатических узлах проводится облучение расширенным полем [27, 28].
- У больных IIB - IVA стадий РШМ рекомендованным стандартом является проведение химиолучевого лечения: сочетанная ЛТ + еженедельное введение цисплатина** в дозе 40 мг/м2 на протяжении лучевой терапии [30 - 34].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - Ia)
Комментарий: Перед ЛТ, при необходимости, выполняется КТ/МРТ брюшной полости и малого таза с внутривенным контрастированием, ПЭТ-КТ для оценки распространенности опухолевого процесса.
ЛТ по радикальной программе должна проводиться не более 6 - 7 недель. Увеличение продолжительности ЛТ терапии снижает выживаемость больных [39, 40].
- Рекомендуется проведения хирургического вмешательства при IIB стадии РШМ, как первым этапом комбинированного лечения или после неоадъювантной химиотерапии.
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - IIb)
Комментарий: Это позволяет избежать поздних осложнений ЛТ и химиолучевого лечения у пациенток, не имеющих факторов неблагоприятного прогноза (таких как метастазы в лимфатических узлах, поражение параметриев и др.). У молодых пациенток можно сохранить функцию яичников и эластичность влагалища. При наличии метастазов в лимфатических узлах у молодых пациенток производится транспозиция яичников из зоны облучения. Кроме того, удаление первичной опухоли предотвращает возникновение радиорезистентности первичной опухоли. Недостатками выполнения операции на первом этапе является риск осложнений связанный с комбинированным или комплексным лечением пациенток.
- В случае метастатического поражения тазовых и/или поясничных лимфатических узлов у больных IIB - IVA стадий РШМ возможно выполнение экстраперитонеальной лимфаденэктомиии с последующим проведением химиолучевой терапии по радикальной программе [37, 38].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - IIb)
Комментарий: Больным с метастазами в поясничных лимфатических узлах проводится облучение расширенным полем [27, 28].
- Роль адъювантной ХТ после химиолучевого лечения по радикальной программе у больных IIB - IVA стадий РШМ не ясна.
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - IIb)
Комментарий: Только одно исследование указывает на значительное преимущество использования адъювантной ХТ после химиолучевого лечения по радикальной программе. Пациентки со IIB2 - IV стадиями РШМ получали цисплатин** 40 мг/м2 + гемцитабин** 125 мг/м2 еженедельно на фоне ЛТ по радикальной программе и 2 курса адъювантной ХТ после окончания ЛТ (цисплатин** 50 мг/м2 в 1 день + гемцитабин** 1000 мг/м2 в 1,8 дни с интервалом в 3 недели). У пациенток, получавших адъювантную ХТ, отмечалось достоверное улучшение выживаемости без прогрессирования и общей выживаемости [41].
- У части больных без перехода опухоли на стенку таза альтернативой химиолучевому лечению может служить экзентерация малого таза (особенно при наличии свищей). Выполнение этого вмешательства возможно первичным больным IVA стадии РШМ и больным с центральным рецидивом, вовлекающим мочевой пузырь и/или прямую кишку, не переходящим на стенку таза, при отсутствии диссеминации по брюшине, регионарных и отдаленных метастазов [42, 43, 44, 45].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - IIb)
Комментарий: Чаще выполняется тотальная экзентерация малого таза (включающая удаление мочевого пузыря, матки, влагалища и прямой кишки). В редких случаях операция может быть ограничена передней экзентерацией (удаление мочевого пузыря, матки, влагалища) или задней экзентерацией (удаление матки, влагалища и прямой кишки).
Расширенная экстирпация матки возможна только у больных после ЛТ/химиолучевого лечения по радикальной программе, если размер рецидивной опухоли в шейке матки не превышает 2 см.
При наличии триады симптомов, включающей односторонние отек нижней конечности, ишиалгию и блок мочеточника, в большинстве случаев, диагностируется переход опухоли на стенку таза, не подлежащий хирургическому лечению. Таким больным показано паллиативное лечение
- Для пациенток с отдаленными метастазами (IVB стадия РШМ) рекомендованным вариантом лечения является системная платиносодержащая химиотерапия. Возможно проведение лучевой терапии по индивидуальному плану.
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - IIa)
3.2 Лучевое лечение
- Применение конформной лучевой терапии является стандартом при проведении курса дистанционного облучения.
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - Ib)
Комментарий: Предварительно проводится топометрическая подготовка пациентов с использованием КТ, а также МРТ и ПЭТ, а также гинекологический осмотр. МРТ является преимущественным методом визуализации мягких тканей органов малого таза с целью определения степени распространенности опухолевого процесса в малом тазу, а также характер вовлечения опухолевой инфильтрации в параметральных областях. Для определения наличия региональных метастатически измененных лимфатических узлов в неоперабельных случаях, исследование ПЭТ является вспомогательным методом исследования.
- Планируемый объем облучения должен включать в себя непосредственно первичную опухоль (при отсутствии хирургического этапа лечения), параметральную область, крестцово-маточные связки, оптимальный отступ от края первичной опухоли, не менее 3 см, с учетом уровня опухолевого поражения влагалища, группу тазовых лимфатических узлов, а также всех остальных региональных лимфатических узлов.
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - Ib)
Комментарий: При отсутствии выявленного метастатического поражения в подвздошных лимфатических узлах после хирургического этапа лечения или первичного комплексного обследования, в объем облучения должны быть включены группа наружных, внутренних подвздошных и запирательные лимфатические узлы. В случаях диагностирования метастического поражения подвздошных и/или парааортальных лимфатических узлов, рекомендовано применение расширенных границ области облучения, верхняя граница поля должна достигать уровня L1 - L2 позвонков, или с учетом уровня поражения группы параортальных лимфатических узлов, соответственно, верхняя граница поля может достигать уровня Th12 [46, 47].
- В случаях диагностирования микроскопического метастатического поражения региональных лимфатических узлов, суммарная доза до 46 Гр достаточна (при ежедневном фракционировании 2 Гр, принятом в России).
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - Ib)
Комментарий: увеличение суммарных доз на область региональных лимфатических узлов в случае их поражения допустимо дополнительно в пределах 10 - 15 Гр в виде локального буста. Большинству больных РШМ проводится одновременная химиотерапия цисплатином** или комбинацией препаратов, которая должна проводиться только во время дистанционного облучения [48].
- Применение IMRT и других методологий конформного облучения должны быть вспомогательными с целью уменьшения дозовых нагрузок на кишечник и другие органы риска в планах облучения, а также в случаях необходимости облучения парааортальной области. Эта методология может быть также вспомогательной в случаях необходимости увеличения суммарных доз при распространенном опухолевом процессе в малом тазу.
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - Ib)
Комментарий: Однако, конформное облучение (такое как IMRT) не заменяет применение брахитерапии в рутинной клинической практике лечения больных распространенных форм рака шейки матки. Методика IMRT требует тщательного подхода в деталях оконтуривания всех клинических объемов, органов риска, укладки пациента на столе, учитывается движение органов во время дыхания, возможная деформация мягких тканей, вследствие распространения опухолевого процесса в малом тазу, а также тщательное дозиметрическое планирование квалифицированным медицинским физиком. Контроль за правильностью укладки пациента на столе линейного ускорителя осуществляется с помощью con-beam CT (CBCT) [47].
- Понятия GTV (определяемый опухолевый объем), CTV (клинический объем мишени, включающий GTV), PTV (планируемый объем мишени), OAR (органы риска) и DVH (гистограммы доза-объем) определены для конформного облучения. Особенно их нужно учитывать для методологии IMRT [48]
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - Ib)
- Внутриполостное облучение (брахитерапия) рекомендуется как определяющий и обязательный этап лечения, при котором заданный локальный объем облучения получает максимальную дозу воздействия практически эквивалентно равную общей дозе, достигнутой от дистанционного этапа облучения. Таким образом, проведение контактного облучения является основным прогностическим фактором в локальном контроле РШМ.
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - Ib)
Комментарий: Исторически сложившаяся концепция расчета поглощенных доз в точках A и B, точках мочевого пузыря и прямой кишки, существует и по настоящее время, применяется как стандартный вид внутриполостного облучения (рекомендации MKPE N 38). В течение последнего десятилетия выработаны рекомендации планирования внутриполостного облучения РШМ на основе развития трехмерной реконструкции изображений. В настоящее время достаточно активно внедрено в практическую клиническую деятельность планирование внутриполостной лучевой терапии РШМ по МРТ изображениям. В ряде клиник, где нет технической возможности использования МРТ, применяются КТ изображения в трехмерной дозиметрии. Получение клиницистом топографо-анатомической информации для оконтуривания остаточного опухолевого объема и органов риска (мочевого пузыря и прямой кишки) в соотношении с установленной системой аппликатора в полость матки, позволяет получить более точное распределение заданной дозы по объему мишени в зависимости от геометрии расположения аппликатора. При малых объемах остаточного опухолевого процесса возможно добиться меньшей нагрузки на критические органы, тогда как при больших объемах - трехмерное планирование помогает оптимизировать дозное распределение для подведения максимальной терапевтической дозы ко всему объему мишени, особенно в случаях неправильной геометрии остаточной опухоли шейки матки, а также максимально снизить нагрузку на критические органы [47, 48, 49, 50]
В России принято использование внутриполостное облучение высокой мощности дозы с использованием радиоактивных источников 60Co и 192Ir.
Рекомендуется проводить внутриполостное облучение после полного курса дистанционной лучевой терапии. В случаях хорошей регрессии опухолевого процесса в малом тазу и формированием шейки матки, возможно начало брахитерапии на 4 - 5й неделе облучения в дни, свободные от дистанционного облучения.
- Для лечения больных РШМ рекомендуется следующая методика сочетанной лучевой терапии по радикальной программе. Суммарные дозы от курса сочетанной лучевой терапии: в т. A 80 - 90 Гр, в т. B 60 Гр.
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - Ib)
Комментарий:
1. Дистанционная лучевая терапия
Конформная лучевая терапия малого таза и зон регионарного метастазирования СОД 46 - 50 Гр (4х-польное облучение, IMRT). Режим фракционирования, принятый в России, 2 Гр ежедневно 5 раз в неделю.
Для 4х-польного облучения учитываются объемы CTV:
- GTV (первичная опухоль) cCTV-T (включает локальную микроскопическую опухолевую инфильтрацию в первичном очаге, матке, параметрии, верхняя треть влагалища, крестцово-маточные связки), CTV-N (региональные лимфатические узлы - запирательные внутренние, наружные и общие подвздошные и верхние пресакральные)
- CTV-PTV границы отступа составляют для CTV-T15 - 20 мм, для CTV-N 7 - 10 мм.
- Органы риска (мочевой пузырь, прямая, толстая и тонкая кишка, головки бедренных костей)
- Расширенные поля облучения включают парааортальную область в случаях диагностирования метастатического поражения парааортальных/общих подвздошных лимфатических узлов. Границы поля от L1 до L5/S1, исключаются из зоны облучения почки, спинной мозг. Облучение проводится одновременно с облучением малого таза.
Возможно использование методики IMRT.
2. Внутриполостная лучевая терапия (на брахитерапевтических аппаратах): HDR (192Ir, 60Co)
Дозиметрическое планирование проводится исходя из наличия технического оснащения клиники:
- Осуществляемое по 2D изображениям.
Задание дозы проводится в системе координат, связанной с источниками облучения (в точках A, определяемой по Манчестерской системе). Также определяются дозовые нагрузки в точках B, мочевого пузыря и прямой кишки согласно рекомендациям о положении референсных точках MKPE N 38.
- Осуществляемое по 3D изображениям.
Необходимое условие - проведение МРТ исследования с установленным аппликатором в полость матки.
Следует учитывать основные объемы мишени:
GTV-B - макроскопически визуализируемый (если имеется) объем опухоли на момент проведения внутриполостного облучения
HRCTV включает в себя GTV-B и всю шейку матки, т.е. непосредственно остаточную опухоль шейки матки, визуализируемую на МРТ сканах;
IRCTV соответствует области первичного локального поражения, включая в себя объем HRCTV с дополнительными отступами от 5 до 15 мм в зависимости от предполагаемой микроинвазии с учетом первичного опухолевого объема в области влагалища, тела матки, параметрия, в области мочевого пузыря и прямой кишки.
При отсутствии технической возможности, осуществляется дозиметрическое планирование по КТ-изображениям, GTV (макроскопически визуализируемый объем опухоли) не может быть оконтурен. Здесь учитывается только CTV (клинический объем мишени) или непосредственно мишень. В данном случае этот объем включает в себя шейку матки, тело матки и своды влагалища. Дно тело матки не включается в CTV, поскольку не является региональной зоной риска, исключением является распространение первичного опухолевого процесса на тело матки (чаще это нижняя треть тела матки), подтвержденное данными УЗИ/МРТ. Параметральная инфильтрация по данным КТ изображений не визуализируется.
При проведении внутриполостного облучения РШМ традиционно выделяют следующие критические органы, на которые следует производить ограничение лучевых нагрузок: мочевой пузырь, прямая и сигмовидная кишки по объемам D1cc, D2cc. При оценке лучевых реакций со стороны указанных критических органов следует учитывать суммарную лучевую нагрузку, полученную при дистанционном облучении и внутриполостной лучевой терапии в единицах EQD2.
Согласно рекомендациям ESTRO, при планировании следует придерживаться ограничений на органы, указанных в Таблице 2.
Таблица 2. Толерантные дозы на критические органы
Орган
Предел дозы EQD2, Гр
Мочевой пузырь
90
Прямая кишка
70
Сигмовидная кишка
70
В том случае, когда не получается получить план, при котором будут выполняться одновременно оба критерия (достаточное дозовое покрытие заданного объема-мишени при одновременном отсутствии превышения пределов лучевых нагрузок на критические органы) решение стоит принимать для каждого пациента индивидуально. Рекомендации и N 89 [48]
- Режим фракционирования.
В настоящее время нет каких-либо однозначных показаний в пользу того или другого режима фракционирования. Более того, нет консенсуса по использованию режима фракционирования дозы. В литературе содержатся данные о следующих режимах: 4 фракций по 7 Гр, 5 фракций по 6 Гр, 6 фракций по 5 Гр и 5 фракций по 5,5 Гр [49]. Следует отметить, что величины доз за фракцию приведены в общем случае для первоначального нормирования по точкам A. При 3D-оптимизации значения доз, предписанных на объем мишени, могут быть больше или меньше в зависимости от дозиметрического планирования, учитывая ограничения по дозам на органы риска.
- Для лечения больных РШМ после хирургического вмешательства рекомендуется следующая методика послеоперационной сочетанной лучевой терапии, которая проводится через 21 - 28 дней после операции.
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - Ib)
Комментарий:
1. Дистанционная лучевая терапия
Конформная лучевая терапия на область малого таза (ложе первичной опухоли) и зоны регионарного метастазирования СОД 46 - 50 Гр (4-х-польное облучение, IMRT). Режим фракционирования, принятый в России, 2 Гр ежедневно 5 раз в неделю.
- Для 4х-польного облучения учитываются объемы CTV:
CTV-T (включает ложе удаленной опухоли, культю влагалища, область параметриев);
CTV-N (регионарные лимфатические узлы - запирательные, внутренние, наружные и общие подвздошные)
CTV-PTV границы отступа составляют для CTV-T 1115 мм, для CTV-N7 - 10 мм.
Органы риска (мочевой пузырь, прямая, толстая и тонкая кишка, головки бедренных костей)
- Для IMRT:
CTV1 - культя влагалища с включением паравагинальной области между мочевым пузырем и прямой кишкой
CTV2 - паравагинальная/параметральная область, проксимальная часть влагалища
CTV3 - включает общие, наружные и внутренние области подвздошных лимфатических узлов
Пресакральная область, включающая мягкие ткани кпереди от S1 - S1 позвонков (минимум 1,0 см)
В область оконтуривания общих, наружных и внутренних подвздошные лимфатических узлов включаются сосуды плюс расширение контура до 7 мм (исключая кости, мышцы, тонкую кишку). Также в зону контура включаются метастатически подозрительные лимфатические узлы, лимфоцеле, и если имеются хирургические клипсы.
Включаются мягкие ткани между внутренними и наружными подвздошными сосудами вдоль стенок костных структур таза.
Пресакральная зона включает зону мягких тканей кпереди от S1 - S2 позвонков минимум 1,5 см.
Верхняя граница: отступ на 7 мм от промежутка между позвонками L4 - 5
Нижняя граница: верхний край головки бедренной кости и паравагинальной области на уровне верхнего края культи влагалища
PTV1 - CTV1 + 15 мм
PTV2 - CTV2 + 10 мм
PTV3 - CTV3 + 7 мм
Общее PTV складывается из суммы PTV1, PTV2 и PTV3
Органы риска:
Кишечник - петли кишечника контурируются от уровня L4 - 5 до сигмовидного изгиба ободочной кишки. Включается сигмовидная кишка, нисходящий/восходящий отделы ободочной кишки.
Прямая кишка - наружный контур стенки прямой кишки от уровня изгиба сигмовидной кишки до ануса
Мочевой пузырь - наружный контур
Кости - кости таза, крестец, тело позвонка L5, вертлужная впадина и проксимальный отдел бедренной кости, головка бедренной кости [48].
2. Внутриполостная лучевая терапия (на брахитерапевтических аппаратах): HDR (192Ir, 60Co)
Внутриполостное облучение культи влагалища РОД 3 - 5 Гр. 2 - 3 раза в неделю, СОД 21 - 25 Гр.
3.3 Лекарственное лечение
- При необходимости проведения адъювантной химиолучевой терапии при IB - IIB стадиях РШМ в группе высокого риска прогрессирования рекомендуется следующий режим химиотерапии: цисплатин** 40 мг/м2 1 раз в неделю до 6 недель на фоне ЛТ [23, 24, 51, 52, 53].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - Ib).
- В случае проведения химиолучевого лечения по радикальной программе у больных IB - IVA стадий РШМ рекомендуется следующий режим химиотерапии: цисплатин** 40 мг/м2 1 раз в неделю до 6 недель на фоне ЛТ [54, 55].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - Ia).
- Роль адъювантной ХТ после химиолучевого лечения по радикальной программе не ясна. Только одно исследование указывает на значительное преимущество использования адъювантной химиотерапии после химиолучевого лечения по радикальной программе [56].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - IIb).
Комментарий: режимы возможной ХЛТ с последующей ХТ согласно приведенному исследованию: цисплатин** 40 мг/м2 + гемцитабин** 125 мг/м2 еженедельно на фоне ЛТ по радикальной программе и 2 курса адъювантной ХТ после окончания ЛТ (цисплатин** 50 мг/м2 в 1-й день + гемцитабин** 1000 мг/м2 в 1-й, 8-й дни с интервалом в 3 недели. Но этот режим более токсичен, чем еженедельный цисплатин**.
- При IB2 и IIA2 (опухоль > 4 см) и IIB стадиях РШМ возможно применение неоадъювантной ХТ (2 - 3 курса) [35, 57 - 61].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - Ib).
Комментарий: режимы химиотерапии: паклитаксел# 175 мг/м2 + цисплатин** 75 мг/м2 в 1-й день с интервалом 3 недели или паклитаксел# 175 мг/м2 + карбоплатин** AUC 6 в 1-й день с интервалом 3 недели. Первый мета-анализ показывает, что неоадьювантная ХТ уменьшает объем опухоли, частоту метастатического поражения регионарных лимфоузлов, уменьшает количество пациенток, которым необходимо проведение адъювантной ЛТ, но не увеличивает общую выживаемость. Второй мета-анализ показал статистически достоверную корелляцию эффекта неоадъювантной ХТ с выживаемостью без прогрессирования и общей выживаемостью.
- Для пациенток с IVB стадией РШМ или при прогрессировании заболевания рекомендована системная химиотерапия [62 - 67].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - Ia).
Комментарий: Режимы химиотерапии:
Цисплатин** 50 мг/м2 1 раз в 21 день, до 6 курсов, или цисплатин** 50 мг/м2 в 1-й день + 5-фторурацил** 500 мг/м2 в 1-й - 3-й дни с интервалом в 21 день, до 6 курсов. Если пациентка ранее получала химиолучевое лечение, в этом случае монотерапия не показана, а рекомендована комбинированная терапия.
Паклитаксел# 175 мг/м2 + цисплатин** 75 мг/м2 в 1-й день с интервалом 3 недели (у больных, получавших ЛТ на область малого таза начальные дозы препаратов могут быть редуцированы до цисплатина** 60 мг/м2 и паклитаксела# до 150 мг/м2. При удовлетворительной переносимости возможна эскалация доз цитостиков до общепринятых).
Паклитаксел# 175 мг/м2 + карбоплатин** AUC 5 - 6 в 1-й день с интервалом 3 недели, или цисплатин** 50 мг/м2 в 1-й день + топотекан 0,75 мг/м2 в 1-й - 3-й дни с интервалом 3 недели, или цисплатин** 50 мг/м2 в 1-й день + ифосфамид** 5000 мг/м2 24-часовая инфузия с месной 400 мг/м2 3 раза в день в 1-й день каждые 3 недели, или цисплатин** 50 мг/м2 в 1-й день + гемцитабин** 1000 мг/м2 в 1-й, 8-й дни с интервалом 3 недели, или цисплатин** 40 мг/м2 в 1-й, 8-й дни + иринотекан# 60 мг/м2 в 1-й, 8-й дни с интервалом 3 недели.
При невозможности применения препаратов платины возможно назначение неплатиновых комбинаций, которые продемонстрировали схожую эффективность с комбинациями на основании препаратов платины: Паклитаксел# 175 мг/м2 в 1-й день + топотекан 0,75 мг/м2 в 1-й - 3-й дни с интервалом 3 недели. Показано добавление бевацизумаба** 15 мг/кг с интервалом 3 недели вместе с химиотерапией до прогрессирования заболевания (по последним данным, показано достоверное улучшение отдаленных результатов лечения при добавлении бевацизумаба** как к платиносодержащим комбинациям, так и к неплатиновым комбинациям).
При прогрессировании РШМ на одной линии химиотерапии возможно проведение второй линии лечения (проводят до прогрессирования или до возникновения непереносимой токсичности) [68 - 72].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - IIb).
Комментарий: Режимы химиотерапии:
Митомицин** - 7,5 мг/м2 1 раз в 6 недель или иринотекан# 125 мг/м2 в 1-й, 8-й, 15-й дни с интервалом 3 недели, или гемцитабин** 1000 мг/м2 в 1-й, 8-й, 15-й дни с интервалом 3 недели, или доцетаксел# 75 мг/м2 с интервалом 3 недели, или капецитабин 2500 мг/м2 в 1-й - 14-й дни с интервалом 3 недели. В случае, если интервал от последней химиотерапии составил более 6 месяцев возможно применение платиносодержащих режимов. Также возможно добавление бевацизумаба** 15 мг/кг к режимам химиотерапии.
3.4 Лечение прогрессирования
- Пациенткам с рецидивом в малом тазу (без отдаленных метастазов), которым ранее проведена ЛТ, возможны: 1) системная химиотерапия; 2) экзентерация малого таза; 3) симптоматическая терапия.
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - IIb)
- Пациенткам с рецидивом в малом тазу (без отдаленных метастазов), которым ранее не проводилась ЛТ, возможны: 1) химиолучевая терапия; 2) экзентерация малого таза.
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - IIb)
- у пациенток с прогрессированием РШМ (при наличии отдаленных метастазов), которые получали химиолучевую терапию как первичное лечение, монотерапия цисплатином** менее эффективна, чем комбинация цитостатиков (см. системная химиотерапия)
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - IIb)
4. Реабилитация
Рекомендуется проводить реабилитацию, ориентируясь на общие принципы реабилитации пациентов после проведенных хирургических вмешательств и/или химиотерапии и/или ЛТ.
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - IV)
5. Профилактика
- Рекомендуется следующий алгоритм наблюдения за пациентками:
- анализ крови на SCC (при плоскоклеточном раке), осмотр гинеколога и взятие мазков на цитологическое исследование, УЗИ брюшной полости, забрюшинного пространства и малого таза 1 раз в 3 месяца в течение первых 2 лет, каждые 6 месяцев в течение 3-го и 4-го года, затем ежегодно;
- рентгенография органов грудной клетки ежегодно
- углубленное обследование (КТ/МРТ брюшной полости и малого таза, рентгенография/КТ грудной клетки) показано при росте SCC, появлении жалоб или находок при гинекологическом осмотре или УЗИ.
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - IV)
6. Дополнительная информация, влияющая на течение и исход заболевания
Критерии оценки качества медицинской помощи
N
Критерии качества
Уровень достоверности доказательств
Уровень убедительности рекомендаций
1.
Выполнена морфологическая верификация диагноза до начала лечения
2.
Выполнено стадирование по TNM
3.
Выполнено гистологическое исследование удаленного препарата, с указанием параметров в соответствии с рекомендациями (при проведении хирургического лечения)
4.
Отсутствие кровотечения в раннем послеоперационном периоде
5.
Выполнена консультация онколога после операции с определением тактики послеоперационной терапии
6.
Адъювантное лечение начато в течение 8 недель после операции
Список литературы
1. Kjaer SK., Frederiksen K., Munk C., Iftner T. Long-term abcolut risk of cervical intraepithelial neoplasia grade 3 or worse following human papillomavirus infection: role of persistence.//J Natl Cancer Inst. - 2010. - V. 102, N 19. - P. 1478 - 88. (https://www.ncbi.nlm.nih.gov/pubmed/20841605.)
2.  AC., (https://www.ncbi.nlm.nih.gov/pubmed/?term=Rodr%C3%ADguez%20AC%5BAuthor%5D&cauthor=true&cauthor_uid=20157096)Schiffman M., (https://www.ncbi.nlm.nih.gov/pubmed/?term=Schiffman%20M%5BAuthor%5D&cauthor=true&cauthor_uid=20157096) Herrero R. et all. Longitudinal study of human papillomavirus persistence and cervical intraepithelial neoplasia grade 2/3: critical role of duration of infection.//(https://www.ncbi.nlm.nih.gov/pubmed/?term=Herrero%20R%5BAuthor%5D&cauthor=true&cauthor_uid=20157096) J Natl Cancer Inst. - 2010. - V. 102, N 5. - P. 315 - 24. (https://www.ncbi.nlm.nih.gov/pubmed/20157096.)
AC., (https://www.ncbi.nlm.nih.gov/pubmed/?term=Rodr%C3%ADguez%20AC%5BAuthor%5D&cauthor=true&cauthor_uid=20157096)Schiffman M., (https://www.ncbi.nlm.nih.gov/pubmed/?term=Schiffman%20M%5BAuthor%5D&cauthor=true&cauthor_uid=20157096) Herrero R. et all. Longitudinal study of human papillomavirus persistence and cervical intraepithelial neoplasia grade 2/3: critical role of duration of infection.//(https://www.ncbi.nlm.nih.gov/pubmed/?term=Herrero%20R%5BAuthor%5D&cauthor=true&cauthor_uid=20157096) J Natl Cancer Inst. - 2010. - V. 102, N 5. - P. 315 - 24. (https://www.ncbi.nlm.nih.gov/pubmed/20157096.)
3. Parkin DMю, (https://www.ncbi.nlm.nih.gov/pubmed/?term=Parkin%20DM%5BAuthor%5D&cauthor=true&cauthor_uid=15761078) Bray F., (https://www.ncbi.nlm.nih.gov/pubmed/?term=Bray%20F%5BAuthor%5D&cauthor=true&cauthor_uid=15761078) Ferlay J., (https://www.ncbi.nlm.nih.gov/pubmed/?term=Ferlay%20J%5BAuthor%5D&cauthor=true&cauthor_uid=15761078) Pisani P. Global cancer statistics, 2002.//(https://www.ncbi.nlm.nih.gov/pubmed/?term=Pisani%20P%5BAuthor%5D&cauthor=true&cauthor_uid=15761078) CA Cancer J Clin. - 2005. - V. 55, N 2. - P. 74 - 108. (https://www.ncbi.nlm.nih.gov/pubmed/15761078.)
4. Comparison of risk factors for invasive squamous cell carcinoma and adenocarcinoma of the cervix: collaborative reanalysis of inpidual data on 8,097 women with squamous cell carcinoma and 1,374 women with adenocarcinoma from 12 epidemiological studies.//(https://www.ncbi.nlm.nih.gov/pubmed/15761078.) Int J Cancer. - 2007. - V. 120, N 4. - P. 885 - 91. (https://www.ncbi.nlm.nih.gov/pubmed/17131323.)
5. ![]() PA., (https://www.ncbi.nlm.nih.gov/pubmed/?term=Dugu%C3%A9%20PA%5BAuthor%5D&cauthor=true&cauthor_uid=23259425) Rebolj M., (https://www.ncbi.nlm.nih.gov/pubmed/?term=Rebolj%20M%5BAuthor%5D&cauthor=true&cauthor_uid=23259425) Garred P., (https://www.ncbi.nlm.nih.gov/pubmed/?term=Garred%20P%5BAuthor%5D&cauthor=true&cauthor_uid=23259425) Lynge E. Immunosuppression and risk of cervical cancer.//(https://www.ncbi.nlm.nih.gov/pubmed/?term=Lynge%20E%5BAuthor%5D&cauthor=true&cauthor_uid=23259425) Expert Rev Anticancer Ther. - 2013. - V. 13, N 1. - P. 29 - 42. (https://www.ncbi.nlm.nih.gov/pubmed/23259425.)
PA., (https://www.ncbi.nlm.nih.gov/pubmed/?term=Dugu%C3%A9%20PA%5BAuthor%5D&cauthor=true&cauthor_uid=23259425) Rebolj M., (https://www.ncbi.nlm.nih.gov/pubmed/?term=Rebolj%20M%5BAuthor%5D&cauthor=true&cauthor_uid=23259425) Garred P., (https://www.ncbi.nlm.nih.gov/pubmed/?term=Garred%20P%5BAuthor%5D&cauthor=true&cauthor_uid=23259425) Lynge E. Immunosuppression and risk of cervical cancer.//(https://www.ncbi.nlm.nih.gov/pubmed/?term=Lynge%20E%5BAuthor%5D&cauthor=true&cauthor_uid=23259425) Expert Rev Anticancer Ther. - 2013. - V. 13, N 1. - P. 29 - 42. (https://www.ncbi.nlm.nih.gov/pubmed/23259425.)
6. Давыдов М.И., Аксель Е.М. Статистика злокачественных новообразований в России и странах СНГ в 2012 г.//М.: Издательская группа РОНЦ, 2014. - 226 с. (https://www.ncbi.nlm.nih.gov/pubmed/23259425.)
7. Globocan 2012: Estimated Cancer Incidence, Mortality and Prevalence Worldwide in 2012. (Internet) (https://www.ncbi.nlm.nih.gov/pubmed/23259425.)
8. Kurman RJ., Carcangiu ML., Harrington CS., Young RH, eds. WHO Classification of Tumors of the Female Reproductive Organs. Geneva, Switzerland: WHO Press; 2014. World Health Organization Classification of Tumors. 4th edition. (https://www.ncbi.nlm.nih.gov/pubmed/23259425.)
9. FIGO Committee on Gynecologic Oncology. Revised FIGO staging for carcinoma of the vulva, cervix, and endometrium.//Int J Gynecol Obstet. - 2009. - V. 105, N 2. - P. 103 - 4. (https://www.ncbi.nlm.nih.gov/pubmed/23259425.)
10. Wiebea E., Dennyb L., Thomasa G. FIGO cancer report 2012. Cancer of the cervix uteri.//Int J Gynecol Obstet. - 2012. - V. 119, S 2. - P. S100 - S109. (https://www.ncbi.nlm.nih.gov/pubmed/23259425.)
11. Hricak H., Gatsonis C., Chi DS. et al. Role of imaging in pretreatment evaluation of early invasive cervical cancer: results of the intergroup study American College of Radiology Imaging Network 6651 - Gynecologic Oncology Group 183.//J Clin Oncol. - 2005. - V. 23, N 36. - P. 9329 - 37. (https://www.ncbi.nlm.nih.gov/pubmed/23259425.)
12. Bipat S., Glas AS, van der Velden J. et al. Computed tomography and magnetic resonance imaging in staging of uterine cervical carcinoma: a systematic review.//Gynecol Oncol. - 2003. - V. 91, N 1. - P. 59 - 66. (https://www.ncbi.nlm.nih.gov/pubmed/23259425.)
13. Amit A., (https://www.ncbi.nlm.nih.gov/pubmed/?term=Amit%20A%5BAuthor%5D&cauthor=true&cauthor_uid=21419325) Schink J., (https://www.ncbi.nlm.nih.gov/pubmed/?term=Schink%20J%5BAuthor%5D&cauthor=true&cauthor_uid=21419325) Reiss A. et al. PET/CT in gynecologic cancer: present applications and future prospects--a clinician"s perspective.//(https://www.ncbi.nlm.nih.gov/pubmed/?term=Reiss%20A%5BAuthor%5D&cauthor=true&cauthor_uid=21419325) Obstet Gynecol Clin North Am. - 2011. - V. 38, N 1. - P. 1 - 21. (https://www.ncbi.nlm.nih.gov/pubmed/21419325.)
14. Webb JC., (https://www.ncbi.nlm.nih.gov/pubmed/?term=Webb%20JC%5BAuthor%5D&cauthor=true&cauthor_uid=11339919) Key CR., (https://www.ncbi.nlm.nih.gov/pubmed/?term=Key%20CR%5BAuthor%5D&cauthor=true&cauthor_uid=11339919) Qualls CR. et al. Population-based study of microinvasive adenocarcinoma of the uterine cervix.//(https://www.ncbi.nlm.nih.gov/pubmed/?term=Qualls%20CR%5BAuthor%5D&cauthor=true&cauthor_uid=11339919) Obstet Gynecol. - 2001. - V. 97, N 5, Pt 1. - P. 701 - 6. (https://www.ncbi.nlm.nih.gov/pubmed/11339919.)
15. Elliott P., Coppleson M., Russell P. et al. Early invasive (FIGO stage IA) carcinoma of the cervix: a clinico-pathologic study of 476 cases.//Int J Gynecol Cancer. - 2000. - V. 10, N 1. - P. 42 - 52. (https://www.ncbi.nlm.nih.gov/pubmed/11339919.)
16. Bouchard-Fortier G., (https://www.ncbi.nlm.nih.gov/pubmed/?term=Bouchard-Fortier%20G%5BAuthor%5D&cauthor=true&cauthor_uid=24480237) Reade CJ., (https://www.ncbi.nlm.nih.gov/pubmed/?term=Reade%20CJ%5BAuthor%5D&cauthor=true&cauthor_uid=24480237) Covens A. Non-radical surgery for small early-stage cervical cancer. Is it time?//(https://www.ncbi.nlm.nih.gov/pubmed/?term=Covens%20A%5BAuthor%5D&cauthor=true&cauthor_uid=24480237) Gynecol Oncol. - 2014. - V. 132, N 3. - P. 624 - 7. (https://www.ncbi.nlm.nih.gov/pubmed/24480237.)
17. Shepherd JH, Spencer C, Herod J, Ind TE. Radical vaginal trachelectomy as a fertilitysparing procedure in women with early-stage cervical cancercumulative pregnancy rate in a series of 123 women.//BJOG. - 2006. - V. 113, N 6. - P. 719 - 24. (https://www.ncbi.nlm.nih.gov/pubmed/24480237.)
18. Landoni F., Maneo A., Colombo A., et al. Randomised study of radical surgery versus radiotherapy for stage Ib - IIa cervical cancer.//Lancet. - 1997. - V. 350, N 9077. - P. 535 - 40. (https://www.ncbi.nlm.nih.gov/pubmed/24480237.)
19. Sakuragi N., (https://www.ncbi.nlm.nih.gov/pubmed/?term=Sakuragi%20N%5BAuthor%5D&cauthor=true&cauthor_uid=10193945) Satoh C., (https://www.ncbi.nlm.nih.gov/pubmed/?term=Satoh%20C%5BAuthor%5D&cauthor=true&cauthor_uid=10193945) Takeda N. et al. Incidence and distribution pattern of pelvic and paraaortic lymph node metastasis in patients with Stages IB, IIA, and IIB cervical carcinoma treated with radical hysterectomy.//(https://www.ncbi.nlm.nih.gov/pubmed/?term=Takeda%20N%5BAuthor%5D&cauthor=true&cauthor_uid=10193945) Cancer. - 1999, - V. 85, N 7. - P. 1547 - 54. (https://www.ncbi.nlm.nih.gov/pubmed/10193945.)
20. Huang H., (https://www.ncbi.nlm.nih.gov/pubmed/?term=Huang%20H%5BAuthor%5D&cauthor=true&cauthor_uid=21907530) Liu J., (https://www.ncbi.nlm.nih.gov/pubmed/?term=Liu%20J%5BAuthor%5D&cauthor=true&cauthor_uid=21907530) Li Y. et al. Metastasis to deep obturator and para-aortic lymph nodes in 649 patients with cervical carcinoma.//(https://www.ncbi.nlm.nih.gov/pubmed/?term=Li%20Y%5BAuthor%5D&cauthor=true&cauthor_uid=21907530) Eur J Surg Oncol. - 2011. - V. 37, N 11. - P. 978 - 83. (https://www.ncbi.nlm.nih.gov/pubmed/21907530.)
21. van Bommel PF., van Lindert AC., Kock HC. et al. A review of prognostic factors in early-stage carcinoma of the cervix (FIGO IB and IIA) and implications for treatment strategy.//Eur J Obstet Gynecol Reprod Biol. - 1987. - V. 26, N 1. - P. 69 - 84. (https://www.ncbi.nlm.nih.gov/pubmed/21907530.)
22. Peters WA., Liu PY., Barrett RJ. et al. Concurrent chemotherapy and pelvic radiation therapy compared with pelvic radiation therapy alone as adjuvant therapy after radical surgery in high-risk early-stage cancer of the cervix.//J Clin Oncol. - 2000. - V. 18, N 8. - P. 1606 - 13. (https://www.ncbi.nlm.nih.gov/pubmed/21907530.)
23. Rotman M., Sedlis A., Piedmonte MR. et al. A phase III randomized trial of postoperative pelvic irradiation in Stage IB cervical carcinoma with poor prognostic features: followup of a gynecologic oncology group study. // Int J Radiat Oncol Biol Phys. - 2006. - V. 65, N 1. - P, 169 - 76. (https://www.ncbi.nlm.nih.gov/pubmed/21907530.)
24. Sedlis A., Bundy BN., Rotman MZ. et al. A randomized trial of pelvic radiation therapy versus no further therapy in selected patients with stage IB carcinoma of the cervix after radical hysterectomy and pelvic lymphadenectomy: a Gynecologic Oncology Group Study.//Gynecol Oncol. - 1999. - V. 73, N 2. - P. 177 - 83. (https://www.ncbi.nlm.nih.gov/pubmed/21907530.)
25. Lintner B., (https://www.ncbi.nlm.nih.gov/pubmed/?term=Lintner%20B%5BAuthor%5D&cauthor=true&cauthor_uid=23722476) Saso S., (https://www.ncbi.nlm.nih.gov/pubmed/?term=Saso%20S%5BAuthor%5D&cauthor=true&cauthor_uid=23722476) Tarnai L. et al. Use of abdominal radical trachelectomy to treat cervical cancer greater than 2 cm in diameter.//(https://www.ncbi.nlm.nih.gov/pubmed/?term=Tarnai%20L%5BAuthor%5D&cauthor=true&cauthor_uid=23722476) Int J Gynecol Cancer. - 2013. - V. 23, N 6. - P. 1065 - 70. (https://www.ncbi.nlm.nih.gov/pubmed/23722476.)
26. Wethington SL., (https://www.ncbi.nlm.nih.gov/pubmed/?term=Wethington%20SL%5BAuthor%5D&cauthor=true&cauthor_uid=23714706) Sonoda Y., (https://www.ncbi.nlm.nih.gov/pubmed/?term=Sonoda%20Y%5BAuthor%5D&cauthor=true&cauthor_uid=23714706) Park KJ. et al. Expanding the indications for radical trachelectomy: a report on 29 patients with stage IB1 tumors measuring 2 to 4 centimeters.//(https://www.ncbi.nlm.nih.gov/pubmed/?term=Park%20KJ%5BAuthor%5D&cauthor=true&cauthor_uid=23714706) Int J Gynecol Cancer. - 2013. - V. 23, N 6. - P. 1092 - 8. (https://www.ncbi.nlm.nih.gov/pubmed/23714706.)
27. Varia MA., Bundy BN., Deppe G. et al. Cervical carcinoma metastatic to para-aortic nodes: extended field radiation therapy with concomitant 5-fluorouracil and cisplatin chemotherapy: a Gynecologic Oncology Group study. // Int J Radiat Oncol Biol Phys. - 1998. - V. 42, N 5. - P. 1015 - 23. (https://www.ncbi.nlm.nih.gov/pubmed/23714706.)
28. Grigsby PW., Lu JD., Mutch DG. et al. Twice-daily fractionation of external irradiation with brachytherapy and chemotherapy in carcinoma of the cervix with positive para-aortic lymph nodes: Phase II study of the Radiation Therapy Oncology Group 92 - 10.//Int J Radiat Oncol Biol Phys. - 1998. - V. 41, N 4. - P. 817 - 22. (https://www.ncbi.nlm.nih.gov/pubmed/23714706.)
29. Landoni F., (https://www.ncbi.nlm.nih.gov/pubmed/?term=Landoni%20F%5BAuthor%5D&cauthor=true&cauthor_uid=11136561) Maneo A., (https://www.ncbi.nlm.nih.gov/pubmed/?term=Maneo%20A%5BAuthor%5D&cauthor=true&cauthor_uid=11136561) Cormio G. et al. Class II versus class III radical hysterectomy in stage IB-IIA cervical cancer: a prospective randomized study.//(https://www.ncbi.nlm.nih.gov/pubmed/?term=Cormio%20G%5BAuthor%5D&cauthor=true&cauthor_uid=11136561) Gynecol Oncol. - 2001. - V. 80, N 1. - P. 3 - 12. (https://www.ncbi.nlm.nih.gov/pubmed/11136561.)
30. Keys HM., (https://www.ncbi.nlm.nih.gov/pubmed/?term=Keys%20HM%5BAuthor%5D&cauthor=true&cauthor_uid=10202166) Bundy BN., (https://www.ncbi.nlm.nih.gov/pubmed/?term=Bundy%20BN%5BAuthor%5D&cauthor=true&cauthor_uid=10202166) Stehman FB. et al. Cisplatin, radiation, and adjuvant hysterectomy compared with radiation and adjuvant hysterectomy for bulky stage IB cervical carcinoma.//(https://www.ncbi.nlm.nih.gov/pubmed/?term=Stehman%20FB%5BAuthor%5D&cauthor=true&cauthor_uid=10202166) N Engl J Med. - 1999. - V. 340, N 15. - P. 1154 - 61. (https://www.ncbi.nlm.nih.gov/pubmed/10202166.)
31. Morris M., (https://www.ncbi.nlm.nih.gov/pubmed/?term=Morris%20M%5BAuthor%5D&cauthor=true&cauthor_uid=10202164) Eifel PJ., (https://www.ncbi.nlm.nih.gov/pubmed/?term=Eifel%20PJ%5BAuthor%5D&cauthor=true&cauthor_uid=10202164) Lu J. et al. Pelvic radiation with concurrent chemotherapy compared with pelvic and para-aortic radiation for high-risk cervical cancer.//(https://www.ncbi.nlm.nih.gov/pubmed/?term=Lu%20J%5BAuthor%5D&cauthor=true&cauthor_uid=10202164) N Engl J Med. - 1999. - V. 340, N 15. - P. 1137 - 43. (https://www.ncbi.nlm.nih.gov/pubmed/10202164.)
32. Peters WA 3rd., (https://www.ncbi.nlm.nih.gov/pubmed/?term=Peters%20WA%203rd%5BAuthor%5D&cauthor=true&cauthor_uid=10764420)Liu PY., (https://www.ncbi.nlm.nih.gov/pubmed/?term=Liu%20PY%5BAuthor%5D&cauthor=true&cauthor_uid=10764420) Barrett RJ 2nd. et al. Concurrent chemotherapy and pelvic radiation therapy compared with pelvic radiation therapy alone as adjuvant therapy after radical surgery in high-risk early-stage cancer of the cervix.//(https://www.ncbi.nlm.nih.gov/pubmed/?term=Barrett%20RJ%202nd%5BAuthor%5D&cauthor=true&cauthor_uid=10764420) J Clin Oncol. - 2000. - V. 18, N 8. - P. 1606 - 13. (https://www.ncbi.nlm.nih.gov/pubmed/10764420.)
33. Whitney CW., (https://www.ncbi.nlm.nih.gov/pubmed/?term=Whitney%20CW%5BAuthor%5D&cauthor=true&cauthor_uid=10334517) Sause W., (https://www.ncbi.nlm.nih.gov/pubmed/?term=Sause%20W%5BAuthor%5D&cauthor=true&cauthor_uid=10334517) Bundy BN. et al. Randomized comparison of fluorouracil plus cisplatin versus hydroxyurea as an adjunct to radiation therapy in stage IIB - IVA carcinoma of the cervix with negative paraaortic lymph nodes: a Gynecologic Oncology Group and Southwest Oncology Group study.//(https://www.ncbi.nlm.nih.gov/pubmed/?term=Bundy%20BN%5BAuthor%5D&cauthor=true&cauthor_uid=10334517)J Clin Oncol. - 1999. - V. 17, N 5. - P. 1339 - 48. (https://www.ncbi.nlm.nih.gov/pubmed/10334517.)
34. Rose PG., (https://www.ncbi.nlm.nih.gov/pubmed/?term=Rose%20PG%5BAuthor%5D&cauthor=true&cauthor_uid=10202165) Bundy BN., (https://www.ncbi.nlm.nih.gov/pubmed/?term=Bundy%20BN%5BAuthor%5D&cauthor=true&cauthor_uid=10202165) Watkins EB. et al. Concurrent cisplatin-based radiotherapy and chemotherapy for locally advanced cervical cancer.//(https://www.ncbi.nlm.nih.gov/pubmed/?term=Watkins%20EB%5BAuthor%5D&cauthor=true&cauthor_uid=10202165) N Engl J Med. - 1999. - V. 340, N 15. - P. 1144 - 53. (https://www.ncbi.nlm.nih.gov/pubmed/10202165.)
35. Rydzewska L., Tierney J., Vale CL. et al. Neoadjuvant chemotherapy plus surgery versus surgery for cervical cancer. Cochrane Database of Systematic Reviews 2012, Issue 12. Art. No.: CD007406. (https://www.ncbi.nlm.nih.gov/pubmed/10202165.)
36. Ye Q., (https://www.ncbi.nlm.nih.gov/pubmed/?term=Ye%20Q%5BAuthor%5D&cauthor=true&cauthor_uid=24022086) Yuan HX., (https://www.ncbi.nlm.nih.gov/pubmed/?term=Yuan%20HX%5BAuthor%5D&cauthor=true&cauthor_uid=24022086) Chen HL. Responsiveness of neoadjuvant chemotherapy before surgery predicts favorable prognosis for cervical cancer patients: a meta-analysis.//(https://www.ncbi.nlm.nih.gov/pubmed/?term=Chen%20HL%5BAuthor%5D&cauthor=true&cauthor_uid=24022086) J Cancer Res Clin Oncol. - 2013. - V. 139, N 11. - P. 1887 - 98. (https://www.ncbi.nlm.nih.gov/pubmed/24022086.)
37. Hacker NF., Wain GV., Nicklin JL. Resection of bulky positive lymph nodes in patients with cervical carcinoma.//Int J Gynecol Cancer. - 1995. - V. 5, N 4. - P. 250 - 6. (https://www.ncbi.nlm.nih.gov/pubmed/24022086.)
38. Kupets R., Thomas GM., Covens A. Is there a role for pelvic lymph node debulking in advanced cervical cancer?//Gynecol Oncol. - 2002. - V. 87, N 2. - P. 163 - 70. (https://www.ncbi.nlm.nih.gov/pubmed/24022086.)
39. Perez CA., Grigsby PW., Castro-Vita H. et al. Carcinoma of the uterine cervix. I. Impact of prolongation of overall treatment time and timing of brachytherapy on outcome of radiation therapy.//Int J Radiat Oncol Biol Phys. - 1995. - V. 32, N 5. - P. 1275 - 88. (https://www.ncbi.nlm.nih.gov/pubmed/24022086.)
40. Lanciano RM., Pajak TF., Martz K., Hanks GE. The influence of treatment time on outcome for squamous cell cancer of the uterine cervix treated with radiation: a patterns-of-care study.//Int J Radiat Oncol Biol Phys. - 1993. - V. 25, N 3. - P. 391 - 7. (https://www.ncbi.nlm.nih.gov/pubmed/24022086.)
41.  A., (https://www.ncbi.nlm.nih.gov/pubmed/?term=Due%C3%B1as-Gonz%C3%A1lez%20A%5BAuthor%5D&cauthor=true&cauthor_uid=21444871)
A., (https://www.ncbi.nlm.nih.gov/pubmed/?term=Due%C3%B1as-Gonz%C3%A1lez%20A%5BAuthor%5D&cauthor=true&cauthor_uid=21444871) ![]() JJ., (https://www.ncbi.nlm.nih.gov/pubmed/?term=Zarb%C3%A1%20JJ%5BAuthor%5D&cauthor=true&cauthor_uid=21444871) Patel F et al. Phase III, open-label, randomized study comparing concurrent gemcitabine plus cisplatin and radiation followed by adjuvant gemcitabine and cisplatin versus concurrent cisplatin and radiation in patients with stage IIB to IVA carcinoma of the cervix.//(https://www.ncbi.nlm.nih.gov/pubmed/?term=Patel%20F%5BAuthor%5D&cauthor=true&cauthor_uid=21444871) J Clin Oncol. - 2011. - V. 29, N 13. - P. 1678 - 85. (https://www.ncbi.nlm.nih.gov/pubmed/21444871.)
JJ., (https://www.ncbi.nlm.nih.gov/pubmed/?term=Zarb%C3%A1%20JJ%5BAuthor%5D&cauthor=true&cauthor_uid=21444871) Patel F et al. Phase III, open-label, randomized study comparing concurrent gemcitabine plus cisplatin and radiation followed by adjuvant gemcitabine and cisplatin versus concurrent cisplatin and radiation in patients with stage IIB to IVA carcinoma of the cervix.//(https://www.ncbi.nlm.nih.gov/pubmed/?term=Patel%20F%5BAuthor%5D&cauthor=true&cauthor_uid=21444871) J Clin Oncol. - 2011. - V. 29, N 13. - P. 1678 - 85. (https://www.ncbi.nlm.nih.gov/pubmed/21444871.)
42. Marnitz S., (https://www.ncbi.nlm.nih.gov/pubmed/?term=Marnitz%20S%5BAuthor%5D&cauthor=true&cauthor_uid=19574795) Dowdy S., (https://www.ncbi.nlm.nih.gov/pubmed/?term=Dowdy%20S%5BAuthor%5D&cauthor=true&cauthor_uid=19574795) Lanowska M. et al. Exenterations 60 years after first description: results of a survey among US and German Gynecologic Oncology Centers.//(https://www.ncbi.nlm.nih.gov/pubmed/?term=Lanowska%20M%5BAuthor%5D&cauthor=true&cauthor_uid=19574795) Int J Gynecol Cancer. - 2009. - V. 19, N 5. - P. 974 - 7. (https://www.ncbi.nlm.nih.gov/pubmed/19574795.)
43. Berek JS., (https://www.ncbi.nlm.nih.gov/pubmed/?term=Berek%20JS%5BAuthor%5D&cauthor=true&cauthor_uid=16054678) Howe C., (https://www.ncbi.nlm.nih.gov/pubmed/?term=Howe%20C%5BAuthor%5D&cauthor=true&cauthor_uid=16054678) Lagasse LD. et al. Pelvic exenteration for recurrent gynecologic malignancy: survival and morbidity analysis of the 45-year experience at UCLA.//(https://www.ncbi.nlm.nih.gov/pubmed/?term=Lagasse%20LD%5BAuthor%5D&cauthor=true&cauthor_uid=16054678) Gynecol Oncol. - 2005. - V. 99, N 1. - P. 153 - 9. (https://www.ncbi.nlm.nih.gov/pubmed/16054678.)
44. Goldberg GL., (https://www.ncbi.nlm.nih.gov/pubmed/?term=Goldberg%20GL%5BAuthor%5D&cauthor=true&cauthor_uid=16426668) Sukumvanich P., (https://www.ncbi.nlm.nih.gov/pubmed/?term=Sukumvanich%20P%5BAuthor%5D&cauthor=true&cauthor_uid=16426668) Einstein MH. et al. Total pelvic exenteration: the Albert Einstein College of Medicine/Montefiore Medical Center Experience (1987 to 2003).//(https://www.ncbi.nlm.nih.gov/pubmed/?term=Einstein%20MH%5BAuthor%5D&cauthor=true&cauthor_uid=16426668) Gynecol Oncol. - 2006. - V. 101, N 2. - P. 261 - 8. (https://www.ncbi.nlm.nih.gov/pubmed/16426668.)
45. Morley GW., (https://www.ncbi.nlm.nih.gov/pubmed/?term=Morley%20GW%5BAuthor%5D&cauthor=true&cauthor_uid=2586960) Hopkins MP., (https://www.ncbi.nlm.nih.gov/pubmed/?term=Hopkins%20MP%5BAuthor%5D&cauthor=true&cauthor_uid=2586960) Lindenauer SM. et al. Pelvic exenteration, University of Michigan: 100 patients at 5 years.//(https://www.ncbi.nlm.nih.gov/pubmed/?term=Lindenauer%20SM%5BAuthor%5D&cauthor=true&cauthor_uid=2586960) Obstet Gynecol. - 1989. - V. 74, N 6. - P. 934 - 43. (https://www.ncbi.nlm.nih.gov/pubmed/2586960.)
46. Hatano K., Sakai M., Araki H. et al. Image-Guided radiation dosimetry for cervical cancer versus classical point A dosimetry//Radiotherapy and Oncology. - 2008. - V. 88, N 2, - P. 241. (https://www.ncbi.nlm.nih.gov/pubmed/2586960.)
47. ![]() R., Haie-Meder C., van Limbergen E. et al. Recommendations from gynaecological (GYN) GEC ESTRO working group (II): Concepts and terms in 3D image-based treatment planning in cervix cancer brachytherapy-3D dose volume parameters and aspects of 3D image-based anatomy, radiation physics, radiobiology.//Radiotherapy and Oncology. - 2006. - V. 78. - P. 67 - 77. (https://www.ncbi.nlm.nih.gov/pubmed/2586960.)
R., Haie-Meder C., van Limbergen E. et al. Recommendations from gynaecological (GYN) GEC ESTRO working group (II): Concepts and terms in 3D image-based treatment planning in cervix cancer brachytherapy-3D dose volume parameters and aspects of 3D image-based anatomy, radiation physics, radiobiology.//Radiotherapy and Oncology. - 2006. - V. 78. - P. 67 - 77. (https://www.ncbi.nlm.nih.gov/pubmed/2586960.)
48. ICRU report N 89 Prescribing, Recording, and Reporting Brachytherapy For Cancer of the Cervix. Prepared in collaboration with Groupe  de
de  - European Society for Radiotherapy and Oncology (GEC-ESTRO) (Published June 2016).//Journal of the ICRU. - 2013. - V. 13, N 1 - 2, 274 P. (https://www.ncbi.nlm.nih.gov/pubmed/2586960.)
- European Society for Radiotherapy and Oncology (GEC-ESTRO) (Published June 2016).//Journal of the ICRU. - 2013. - V. 13, N 1 - 2, 274 P. (https://www.ncbi.nlm.nih.gov/pubmed/2586960.)
49. Vishwanathan A.N., Beriwal S., De Los Santos J.F. et al. American Brachytherapy Society consensus guidelines for locally advanced carcinoma of the cervix. Part II: High-dose-rate brachytherapy.//Brachytherapy. - 2012. - V. 11. - P. 47 - 52. (https://www.ncbi.nlm.nih.gov/pubmed/2586960.)
50. Hellebust T.A., Kirisits C., Berger D. Recommendations for gynaecological (GYN) GEC-ESTRO working group: considerations and pitfalls in commissioning and applicator reconstruction in 3D image-based treatment planning of cervix cancer brachytherapy.//Radiotherapy and Oncology. - 2010. - V. 96. - P. 153 - 160. (https://www.ncbi.nlm.nih.gov/pubmed/2586960.)
51. Monk BJ., Wang J., Im S. et al. Rethinking the use of radiation and chemotherapy after radical hysterectomy: a clinical-pathologic analysis of a Gynecologic Oncology Group/Southwest Oncology Group/Radiation Therapy Oncology Group trial.//Gynecol Oncol. - 2005. - V. 96. - P. 721 - 728. (https://www.ncbi.nlm.nih.gov/pubmed/2586960.)
52. Chernofsky MR, Felix JC, Muderspach LI, et al. Influence of quantity of lymph vascular space invasion on time to recurrence in women with early-stage squamous cancer of the cervix. GynecolOncol 2006; 100: 288 - 293. (https://www.ncbi.nlm.nih.gov/pubmed/2586960.)
53. Marchiole P, Buenerd A, Benchaib M, et al. Clinical significance of lympho vascular space involvement and lymph node micrometastases in early-stage cervical cancer: a retrospective case-control surgico-pathological study. GynecolOncol 2005; 97: 727 - 732. (https://www.ncbi.nlm.nih.gov/pubmed/2586960.)
54. Reducing uncertainties about the effects of chemoradiotherapy for cervical cancer: a systematic review and meta-analysis of inpidual patient data from 18 randomized trials. J ClinOncol 2008; 26: 5802 - 5812 (https://www.ncbi.nlm.nih.gov/pubmed/2586960.)
55. Pearcey R, Miao Q, Kong W, et al. Impact of adoption of chemoradiotherapy on the outcome of cervical cancer in Ontario: results of a population-based cohort study. J ClinOncol 2007; 25: 2383 - 2388. (https://www.ncbi.nlm.nih.gov/pubmed/2586960.)
56. Mileshkin LR, Narayan K, Moore KN, et al. A phase III trial of adjuvant chemotherapy following chemoradiation as primary treatment for locally advanced cervical cancer compared to chemoradiation alone: Outback (ANZGOG0902/GOG0274/RTOG1174) [abstract]. Journal of Clinical Oncology 2014 32: abstract TPS5632. (https://www.ncbi.nlm.nih.gov/pubmed/2586960.)
57. Gong L, Lou JY, Wang P, et al. Clinical evaluation of neoadjuvant chemotherapy followed by radical surgery in the management of stage IB2 - IIB cervical cancer. Int J GynaecolObstet 2012; 117: 23 - 26. (https://www.ncbi.nlm.nih.gov/pubmed/2586960.)
58. Eddy GL, Bundy BN, Creasman WT, et al. Treatment of ("bulky") stage IB cervical cancer with or without neoadjuvant vincristine and cisplatin prior to radical hysterectomy and pelvic/para-aortic lymphadenectomy: a phase III trial of the gynecologic oncology group. GynecolOncol 2007; 106: 362 - 369. (https://www.ncbi.nlm.nih.gov/pubmed/2586960.)
59. Rydzewska L, Tierney J, Vale CL, Symonds PR. Neoadjuvant chemotherapy plus surgery versus surgery for cervical cancer. Cochrane Database Syst Rev 2010: CD007406 (https://www.ncbi.nlm.nih.gov/pubmed/2586960.)
60. Katsumata N, Yoshikawa H, Kobayashi H, et al. Phase III randomised controlled trial of neoadjuvant chemotherapy plus radical surgery vs radical surgery alone for stages IB2, IIA2, and IIB cervical cancer: a Japan Clinical Oncology Group trial (JCOG 0102). Br J Cancer 2013; 108: 1957 - 1963 (https://www.ncbi.nlm.nih.gov/pubmed/2586960.)
61. Kim HS, Sardi JE, Katsumata N, et al. Efficacy of neoadjuvant chemotherapy in patients with FIGO stage IB1 to IIA cervical cancer: an international collaborative meta-analysis. Eur J SurgOncol 2013; 39: 115 - 124 (https://www.ncbi.nlm.nih.gov/pubmed/2586960.)
62. Kim JS, Kim SY, Kim KH, Cho MJ. Hyperfractionated radiotherapy with concurrent chemotherapy for para-aortic lymph node recurrence in carcinoma of the cervix. Int J RadiatOncolBiolPhys 2003; 55: 1247 - 1253. (https://www.ncbi.nlm.nih.gov/pubmed/2586960.)
63. Chung YL, Jian JJ, Cheng SH, et al. Extended-field radiotherapy and high-dose-rate brachytherapy with concurrent and adjuvant cisplatin-based chemotherapy for locally advanced cervical cancer: a phase I/II study. GynecolOncol 2005; 97: 126 - 135 (https://www.ncbi.nlm.nih.gov/pubmed/2586960.)
64. Penson RT, Huang HQ, Wenzel LB, et al. Bevacizumab for advanced cervical cancer: patient-reported outcomes of a randomised, phase 3 trial (NRG Oncology-Gynecologic Oncology Group protocol 240). Lancet Oncol 2015; 16: 301 - 311 (https://www.ncbi.nlm.nih.gov/pubmed/2586960.)
65. Kitagawa R, Katsumata N, Shibata T, et al. Paclitaxel Plus Carboplatin Versus Paclitaxel Plus Cisplatin in Metastatic or Recurrent Cervical Cancer: The Open-Label Randomized Phase III Trial JCOG0505. J ClinOncol 2015; 33: 2129 - 2135 (https://www.ncbi.nlm.nih.gov/pubmed/2586960.)
66. Moore KN, Herzog TJ, Lewin S, et al. A comparison of cisplatin/paclitaxel and carboplatin/paclitaxel in stage IVB, recurrent or persistent cervical cancer. GynecolOncol 2007; 105: 299 - 303 (https://www.ncbi.nlm.nih.gov/pubmed/2586960.)
67. Lorusso D, Petrelli F, Coinu A, et al. A systematic review comparing cisplatin and carboplatin plus paclitaxel-based chemotherapy for recurrent or metastatic cervical cancer. GynecolOncol 2014; 133: 117 - 123 (https://www.ncbi.nlm.nih.gov/pubmed/2586960.)
68. Leath CA, 3rd, Straughn JM, Jr. Chemotherapy for advanced and recurrent cervical carcinoma: results from cooperative group trials. GynecolOncol 2013; 129: 251 - 257 (https://www.ncbi.nlm.nih.gov/pubmed/2586960.)
69. Wagenaar HC, Pecorelli S, Mangioni C, et al. Phase II study of mitomycin-C and cisplatin in disseminated, squamous cell carcinoma of the uterine cervix. A European Organization for Research and Treatment of Cancer (EORTC) Gynecological Cancer Group study. Eur J Cancer 2001; 37: 1624 - 1628. (https://www.ncbi.nlm.nih.gov/pubmed/2586960.)
70. Verschraegen CF, Levy T, Kudelka AP, et al. Phase II study of irinotecan in prior chemotherapy-treated squamous cell carcinoma of the cervix. J ClinOncol 1997; 15: 625 - 631 (https://www.ncbi.nlm.nih.gov/pubmed/2586960.)
71. Garcia AA, Blessing JA, Vaccarello L, Roman LD. Phase II clinical trial of docetaxel in refractory squamous cell carcinoma of the cervix: a Gynecologic Oncology Group Study. Am J ClinOncol 2007; 30: 428 - 431 (https://www.ncbi.nlm.nih.gov/pubmed/2586960.)
Schilder RJ, Blessing J, Cohn DE. Evaluation of gemcitabine in previously treated patients with non-squamous cell carcinoma of the cervix: a phase II study of the Gynecologic Oncology Group. GynecolOncol 2005; 96: 103 - 107. (https://www.ncbi.nlm.nih.gov/pubmed/2586960.)
Приложение А1
СОСТАВ РАБОЧЕЙ ГРУППЫ
Кравец О.А., д.м.н., ведущий научный сотрудник отделения радиохирургии, ФГБУ "Российский онкологический научный центр им. Н.Н. Блохина" Минздрава России, Москва
Кузнецов В.В., д.м.н., профессор, заведующий отделения гинекологического, ФГБУ "Российский онкологический научный центр им. Н.Н. Блохина" Минздрава России, Москва
Морхов К.Ю., к.м.н., старший научный сотрудник отделения гинекологического, ФГБУ "Российский онкологический научный центр им. Н.Н. Блохина" Минздрава России, Москва
Нечушкина В.М., д.м.н., старший научный сотрудник отделения гинекологического, ФГБУ "Российский онкологический научный центр им. Н.Н. Блохина" Минздрава России, Москва
Хохлова С.В., д.м.н., старший научный сотрудник отделения химиотерапии ФГБУ "Российский онкологический научный центр им. Н.Н. Блохина" Минздрава России, Москва
Конфликта интересов нет
Приложение А2
МЕТОДОЛОГИЯ РАЗРАБОТКИ КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ
Целевая аудитория данных клинических рекомендаций:
1. Врачи-онкологи;
2. Врачи-хирурги;
3. Врачи-радиологи;
4. Врачи-химиотерапевты;
5. Студенты медицинских ВУЗов, ординаторы и аспиранты.
Методы, использованные для сбора/селекции доказательств: поиск в электронных базах данных; анализ современных научных разработок по проблеме РБ в РФ и за рубежом; обобщение практического опыта российских и зарубежных специалистов.
Таблица П1 - Уровни достоверности доказательств в соответствии с классификацией Агентства по политике медицинского обслуживания и исследований (AHCPR, 1992)
Уровни достоверности доказательств
Описание
Ia
Доказательность, основанная на мета-анализе рандомизированных контролируемых исследований
Ib
Доказательность, основанная как минимум на одном рандомизированном контролируемом исследовании с хорошим дизайном
IIa
Доказательность, основанная как минимум на одном крупном нерандомизированном контролируемом исследовании
IIb
Доказательность, основанная как минимум на одном квазиэкспериментальном исследовании с хорошим дизайном
III
Доказательность, основанная на неэкспериментальных описательных исследованиях с хорошим дизайном, типа сравнительных исследований, корреляционных исследований и исследований случай-контроль
IV
Доказательность, основанная на мнении экспертов, на опыте или мнении авторов
Таблица П2 - Уровни убедительности рекомендаций в соответствии с классификацией Агентства исследований и оценки качества медицинского обслуживания (AHRQ, 1994)
Уровень убедительности рекомендации
Уровни достоверности доказательств
Описание
A
Ia, Ib
Доказательность, основанная как минимум на одном рандомизированном контролируемом исследовании с хорошим дизайном
B
IIa, IIb, III
Доказательность, основанная на хорошо выполненных нерандомизированных клинических исследованиях
C
IV
Доказательность, основанная на мнении экспертов, на опыте или мнении авторов. Указывает на отсутствие исследований высокого качества
Методы, использованные для формулирования рекомендаций - консенсус экспертов.
Экономический анализ
Анализ стоимости не проводился и публикации по фармакоэкономике не анализировались.
Метод валидизации рекомендаций:
- Внешняя экспертная оценка
- Внутренняя экспертная оценка
Описание метода валидизации рекомендаций
Настоящие рекомендации в предварительной версии рецензированы независимыми экспертами, которые попросили прокомментировать, прежде всего, насколько интерпретация доказательств, лежащих в основе рекомендаций, доступна для понимания.
Получены комментарии со стороны врачей-онкологов первичного звена в отношении доходчивости изложения рекомендаций и их оценки важности рекомендаций как рабочего инструмента повседневной практики.
Комментарии, полученные от экспертов, тщательно систематизировались и обсуждались председателем и членами рабочей группы. Каждый пункт обсуждался и вносимые в результате этого изменения в рекомендации регистрировались. Если же изменения не вносились, то регистрировались причины отказа от внесения изменений.
Консультации и экспертная оценка: Проект рекомендаций рецензирован также независимыми экспертами, которых попросили прокомментировать, прежде всего, доходчивость и точность интерпретации доказательной базы, лежащей в основе рекомендаций.
Для окончательной редакции и контроля качества рекомендации повторно проанализированы членами рабочей группы, которые пришли к заключению, что все замечания и комментарии экспертов приняты во внимание, риск систематических ошибок при разработке рекомендаций сведен к минимуму.
Обновления клинических рекомендаций: актуализация проводится не реже чем один раз в три года с учетом появившейся новой информации о диагностике и тактике ведения пациентов РШМ. Решение об обновлении принимает МЗ РФ на основе предложений, представленных медицинскими профессиональными некоммерческими организациями. Сформированные предложения должны учитывать результаты комплексной оценки лекарственных препаратов, медицинских изделий, а также результаты клинической апробации.
При отборе публикаций, как потенциальных источников доказательств, использованная в каждом исследовании методология изучается для того, чтобы убедиться в ее достоверности. Результат изучения влияет на уровень доказательств, присваиваемый публикации, что в свою очередь влияет на силу, вытекающих из нее рекомендаций.
Приложение А3
СВЯЗАННЫЕ ДОКУМЕНТЫ
Типовую стандартизированную схему ведения пациентов можно скачать здесь (http://democenter.nitrosbase.com/clinrecalg5/Files/TypicalSchemes/A-C53.zip)
КР400. Хронический болевой синдром (ХБС) у взрослых пациентов, нуждающихся в паллиативной медицинской помощи (http://cr.rosminzdrav.ru/#!/schema/708)
Приложение Б
АЛГОРИТМЫ ВЕДЕНИЯ ПАЦИЕНТА
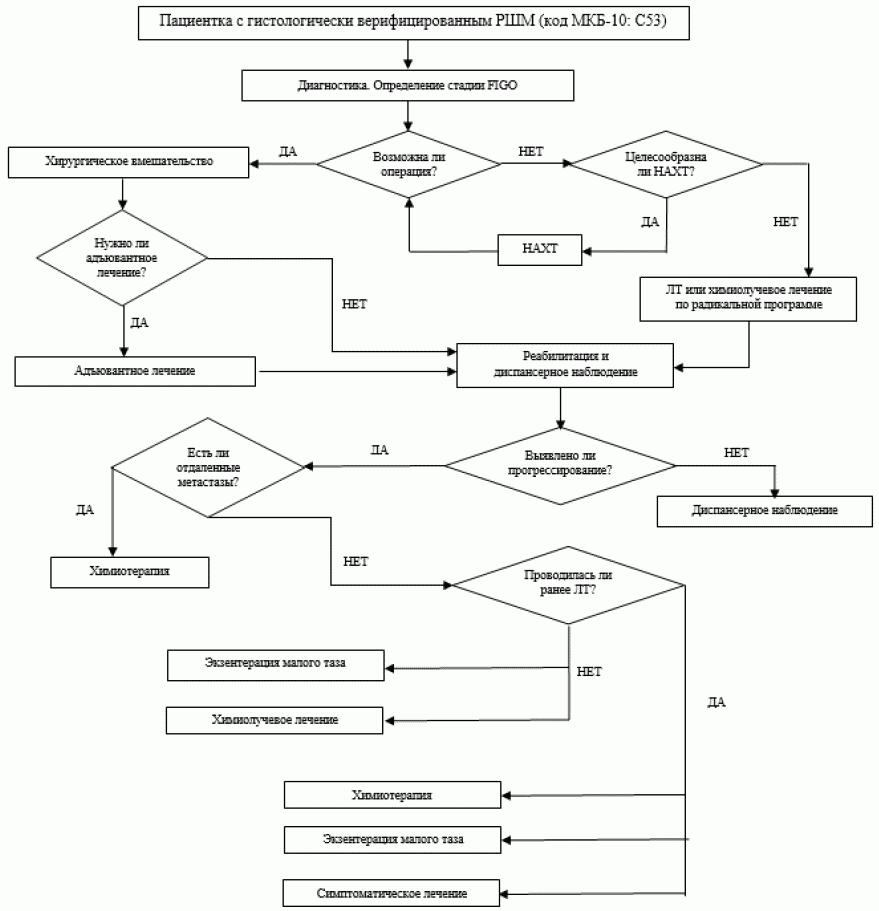
Приложение В
ИНФОРМАЦИЯ ДЛЯ ПАЦИЕНТОВ
Рекомендации при осложнениях химиотерапии - связаться с химиотерапевтом.
1). При повышении температуры тела 38 °C и выше:
- Начать прием антибиотиков: по рекомендации химиотерапевта
2). При стоматите.
- Диета - механическое, термическое щажение;
- Частое полоскание рта (каждый час) - ромашка, кора дуба, шалфей, смазывать рот облепиховым (персиковым) маслом;
- Обрабатывать полость рта по рекомендации химиотерапевта
3). При диарее.
- Диета - исключить жирное, острое, копченое, сладкое, молочное, клетчатку. Можно нежирное мясо, мучное, кисломолочное, рисовый отвар. Обильное питье.
- Принимать препараты по рекомендации химиотерапевта
4). При тошноте.
- Принимать препараты по рекомендации химиотерапевта
Приложение Г
