"Клинические рекомендации "Рак прямой кишки"
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ
РАК ПРЯМОЙ КИШКИ
МКБ 10: C20
Год утверждения (частота пересмотра): 2018 (пересмотр каждые 3 года)
ID: КР554
URL
Профессиональные ассоциации
- Ассоциация онкологов России Российское общество клинической онкологии
Ключевые слова
- Рак ободочной кишки
- Рак ректосигмоидного отдела
- Адъювантная химиотерапия
- Системная химиотерапия
Список сокращений
МКА - моноклональные антитела
КТ - компьютерная томография
МРТ - магнитно-резонансная томография
ПЭТ - позитронно-эмиссионная томография
РЧА - радиочастотная аблация
УЗДГ - ультразвуковая допплерография
УЗИ - ультразвуковое исследование
ЭКГ - электрокардиография
IMRT - модулированная по интенсивности лучевая терапия
VMAT - объемно модулированное облучение
Термины и определения
1. Краткая информация
1.1 Определение
Рак прямой кишки - злокачественная опухоль, развивающаяся из клеток эпителия прямой кишки и локализующаяся в пределах 15 см от ануса при измерении ригидным ректоскопом. В клинической практике и при описании результатов научных исследований рак прямой кишки разделяют на нижнеампулярный (0 - 5 см от анокутанной линии), среднеампулярный (5 - 10 см от анокутанной линии), верхнеампулярный (10 - 15 см от анокутанной линии).
1.2 Этиология и патогенез
У 3 - 5% больных раком прямой кишки развитие заболевания связано с наличием известных наследственных синдромов. Наиболее распространенные - синдром Линча и семейный аденоматоз толстой кишки. У оставшихся пациентов рак ободочной и прямой кишки имеет спорадический характер. В качестве факторов риска развития данного заболевания рассматриваются: хронические воспалительные заболевания толстой кишки (например, неспецифический язвенный колит, болезнь Крона); курение, алкоголь, превалирование в рационе красного мяса, наличие сахарного диабета, ожирение или повышенный индекс массы тела, низкая физическая активность [1 - 13]. Предполагается, что у большинства пациентов рак прямой кишки развивается на фоне полипов. При длительном существовании на фоне полипа развивается дисплазия эпителия, степень дисплазии нарастает, пока в структуре полипа не появляются злокачественные клетки.
1.3 Эпидемиология
Рак прямой кишки занимает лидирующие позиции по заболеваемости и смертности от злокачественных опухолей. В 2014 году в России зарегистрировано 13 099 новых случаев рака прямой кишки и умерло по этой причине 16 795 больных [14].
1.4 Кодирование по МКБ 10
C20 Злокачественное новообразование (ЗНО) прямой кишки.
1.5 Классификация
1.5.1 Международная гистологическая классификация (2010)
Эпителиальные опухоли
I. Доброкачественные опухоли
a. 8211/0 Тубулярная аденома
b. 8261/0 Ворсинчатая аденома
c. 8263/0 Тубулярно-ворсинчатая аденома
d. 8220/0 Аденоматозный полип
II. Интраэпителиальная неоплазия (дисплазия), связанная с хроническими воспалительными заболеваниями кишечника
a. 8148/2 Железистая интраэпителиальная неоплазия высокой степени
b. 8148/0 Железистая интраэпителиальная неоплазия низкой степени
III. Рак <*>
a. 8220/3 Аденокарцинома
b. 8480/3 Муцинозная аденокарцинома <**>
c. 8490/3 Перстневидноклеточный рак <***>
d. 8041/3 Мелкоклеточный рак
e. 8070/3 Плоскоклеточный рак
f. 8560/3 Аденоплоскоклеточный рак
g. 8510/3 Медуллярный рак
h. 8220/3 4 Недифференцированный рак
--------------------------------
<*> Опухоли делятся на высоко- (более чем в 95% клеток определяются железистые структуры), умеренно- (железистые структуры определяются в 50 - 95% клеток), низкодифференцированные (железистые структуры определяются в 5 - 50% клеток) и недифференцированные (железистые структуры определяются в < 5% клеток).
<**> Устанавливается, если > 50% объема опухоли представлено внеклеточной слизью. Всегда расцениваются как низкодифференцированные.
<***> Устанавливается, если > 50% внутриклеточного объема представлено слизью. Всегда расцениваются как низкодифференцированные.
1.6 Стадирование
1.6.1 Стадирование рака прямой кишки по системе TNM7 (2009)
Для рака ободочной и прямой кишки используется единая классификация.
Символ T содержит следующие градации:
TX - недостаточно данных для оценки первичной опухоли.
Tis - преинвазивный рак (интраэпителиальная инвазия или инвазия собственной пластинки слизистой оболочки).
T1 - опухоль распространяется в подслизистый слой стенки кишки
T2 - опухоль распространяется на мышечный слой, без прорастания стенки кишки.
T3 - опухоль прорастает все слои стенки кишки с распространением в жировую клетчатку, без поражения соседних органов.
Для опухолей, расположенных в верхнеампулярном отделе прямой кишки и ректосигмоидном отделах ободочной кишки (покрытых брюшиной), символ T3 характеризует распространение опухоли до субсерозной оболочки (не прорастают серозную оболочку).
T4 - опухоль прорастает в окружающие органы и ткани или серозную оболочку при локализации в верхнеампулярном отделе прямой кишки и ректосигмоидном отделах ободочной кишки (покрытых брюшиной).
T4a - прорастание висцеральной брюшины
T4b - прорастание в другие органы и структуры
Символ N указывает на наличие или отсутствие метастазов в регионарных лимфатических узлах
NX - недостаточно данных для оценки регионарных лимфатических узлов.
N0 - поражения регионарных лимфатических узлов нет.
N1 - метастазы в 1 - 3 (включительно) регионарных лимфатических узлах.
N1a - метастазы в 1 регионарном лимфатическом узле.
N1b - 2 - 3 лимфатических узла.
N1c - диссеминаты в брыжейке без поражения регионарных лимфатических узлов
N2 - метастазы в более чем 3-х регионарных лимфатических узлах.
N2a - поражено 4 - 6 лимфатических узлов.
N2b - поражено 7 и более лимфатических узлов.
Символ M характеризует наличие или отсутствие отдаленных метастазов
M0 - отдаленных метастазов нет.
M1 - наличие отдаленных метастазов.
M1a - наличие отдаленных метастазов в одном органе.
M1b - наличие отдаленных метастазов более чем в одном органе или по брюшине.
Группировка по стадиям представлена в таблице 1:
Таблица 1 - Стадии рака толстой кишки
Стадия
T
N
M
0
is
0
0
I
1, 2
0
0
II
3, 4
0
0
IIA
3
0
0
IIB
4a
0
0
IIC
4b
0
0
III
Любая
1, 2
0
IIIA
1, 2
1
0
1
2a
0
IIIB
3, 4a
1
0
2, 3
2a
0
IIIC
4b
1, 2a, 2b
0
4a
2a
0
3, 4a
2b
0
IV
Любая
Любая
1
IVa
Любая
Любая
1a
IVb
Любая
Любая
1b
1.6.2 Стадирование по Kikuchi раннего рака прямой кишки
При планировании местного иссечения T1 рака прямой кишки предлагается детальное стадирование заболевания на основании данных МРТ и УЗ-колоноскопии по следующим критериям:
T1sm1 - глубина инвазии подслизистого слоя до 1/3.
T1sm2 - умеренная глубина инвазии подслизистого слоя - до 2/3
T1sm3 - полная инвазия опухолью всего подслизистого слоя
Окончательное стадирование проводится по результатам гистологического исследования после удаления опухоли.
2. Диагностика
2.1 Жалобы и анамнез
- Рекомендуется тщательный сбор жалоб и анамнеза у пациента с целью выявления факторов, которые могут повлиять на выбор тактики лечения.
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - IV)
Комментарии: У 3 - 5% больных раком прямой кишки развитие заболевания связано с наличием известных наследственных синдромов. Наиболее распространенные - синдром Линча и семейный аденоматоз толстой кишки.
- У всех больных колоректальным раком после подтверждения диагноза рекомендуется собрать семейный анамнез и проанализировать его на соответствие критериям Amsterdam II и Bethesda [2].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - IIb)
2.2 Физикальное обследование
- Рекомендуется тщательный физикальный осмотр, включающий пальцевое ректальное исследование, оценку нутритивного статуса.
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - IV)
2.3 Лабораторная диагностика
- Рекомендуется выполнять: развернутые клинический и биохимический анализы крови, онкомаркеры РЭА, CA 19.9, исследование свертывающей системы крови, анализ мочи.
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - IV)
2.4 Инструментальная диагностика
- Рекомендуется выполнить тотальную колоноскопию с биопсией - наиболее информативный метод исследования при раке прямой кишки, позволяющий непосредственно визуализировать опухоль, определить ее размеры, локализацию и макроскопический тип, оценить угрозу осложнений (кровотечение, перфорация), а также получить материал для морфологического исследования. Для получения достаточного количества материала требуется выполнить несколько (3 - 5) биопсий стандартными эндоскопическими щипцами.
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - IV)
Комментарий: План лечения не следует составлять до получения данных биопсии. При подслизистом инфильтративном росте опухоли возможен ложноотрицательный результат, что требует повторной глубокой биопсии. Чувствительность и специфичность метода возрастает при использовании современных технологий эндоскопической визуализации (увеличительной эндоскопии, узкоспектральной эндоскопии, хромоэндоскопии, флуоресцентной диагностики). Если тотальная колоноскопия не была выполнена на дооперационном этапе, ее необходимо провести в течение 3 - 6 месяцев после хирургического лечения.
- Рекомендуется выполнить МРТ малого таза перед планированием химиолучевой терапии и перед хирургическим лечением [38, 42 - 45].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - IIb)
Комментарий: МРТ малого таза позволяет определить локализацию, протяженность, глубину инвазии опухоли, оценить состояние регионарных лимфатических узлов. Протокол заключения МРТ малого таза при раке прямой кишки должен включать следующую информацию:
размеры опухоли, глубину инвазии в стенку прямой кишки, минимальное расстояние от края опухоли до мезоректальной фасции, количество и размеры лимфатических узлов параректальной клетчатки, наличие МР-признаков их злокачественного поражения, наличие вовлечения мезоректальной фасции потенциально пораженными лимфатическими узлами, наличие венозной инвазии, количество и размеры экстрафасциальных лимфатических узлов, наличие МР-признаков их злокачественного поражения; для рака нижнеампулярного отдела прямой кишки - наличие инвазии внутреннего сфинктера/межсфинктерного пространства/наружного сфинктера/мышц поднимающих задний проход.
Современные режимы МРТ с использованием диффузно-взвешенных изображений могут повысить информативность проводимого исследования. Внутривенное контрастирование не повышает информативность оценки распространенности опухоли [46]. Окончательное принятие решение о тактике лечения больных раком прямой кишки возможно только по результатам МРТ-исследования.
- Рекомендуется выполнить ирригоскопию или КТ-колонографию при невозможности выполнения тотальной колоноскопии.
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - IV)
Комментарий: В 4 - 5% случаев встречаются синхронные образования, которые могут быть пропущены при пальпаторной ревизии на операции [15, 16]. Поэтому полное обследование толстой кишки рекомендуется выполнять всем пациентам до хирургического лечения, при технической невозможности - не позднее 3 месяцев после хирургического лечения. КТ-колонография имеет большую по сравнению с ирригоскопией чувствительность в выявлении полипов, особенно в проксимальных отделах толстой кишки [17].
- Рекомендуется до начала лечения выполнить УЗИ органов брюшной полости и забрюшинного пространства либо КТ органов брюшной полости с внутривенным контрастированием.
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - IV)
Комментарий: КТ органов брюшной полости и грудной клетки является стандартом уточняющей диагностики при раке прямой кишки в большинстве развитых стран. На практике данные исследования могут быть отчасти заменены УЗИ органов брюшной полости и рентгенографией грудной клетки в двух проекциях у пациентов с небольшой местной распространенностью опухолевого процесса.
- Рекомендуется выполнить рентгенографию грудной клетки либо КТ органов грудной клетки.
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - IV)
- Рекомендуется выполнить ЭКГ.
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - IV)
- Рекомендуется выполнить УЗ-колоноскопию при планировании местного иссечения T1sm1 и ворсинчатых опухолей прямой кишки. [18]
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - IIb)
- Рекомендуется выполнить МРТ органов брюшной полости с внутривенным контрастированием при планировании резекции печени в случаях, когда КТ не позволяет в полной мере высказаться о распространенности процесса в печени. [19]
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - Ia)
- Рекомендуется выполнить остеосцинтиграфию при подозрении на метастатическое поражение костей скелета.
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - IV)
- Рекомендуется выполнить биопсию под контролем УЗИ/КТ при подозрении на метастазы по данным КТ или МРТ в случаях, когда их подтверждение принципиально меняет тактику лечения.
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - IV)
- Рекомендуется выполнить ПЭТ - КТ при подозрении на метастазы по данным КТ или МРТ в случаях, когда их подтверждение принципиально меняет тактику лечения.
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - IV)
- Рекомендуется выполнить лапароскопию при подозрении на диссеминацию опухоли по брюшине.
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - IV)
- Рекомендуется выполнить МРТ или КТ головного мозга с внутривенным контрастированием при подозрении на метастатическое поражение головного мозга.
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - IV)
- Рекомендуется при подготовке к хирургическому лечению с целью оценки функционального статуса по показаниям проводить дополнительное обследование: эхокардиографию, холтеровское мониторирование сердечной деятельности, исследование функции внешнего дыхания, УЗДГ сосудов шеи и нижних конечностей, консультации кардиолога, эндокринолога, невропатолога и т.п.
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - IV)
2.5 Иная диагностика
- Рекомендуется выполнить анализ биоптата опухоли на мутацию RAS (экзоны 2 - 4 генов KRAS и NRAS), если диагностированы или заподозрены отдаленные метастазы аденокарциномы, это может повлиять на выбор таргетного агента в лечении метастатического процесса [25].
Уровень убедительности рекомендаций A (уровень достоверности доказательств - Ia)
- Генетическое тестирование рекомендуется в следующих случаях:
1) Подозрение на синдром Линча. Выполняется тестирование на мутации в генах MLH1, MSH2, MSH6, PMS2:
- при соответствии пациента критериям Amsterdam II (приложение C)
- при наличии у пациента родственника первой или второй линии с установленным диагнозом синдрома Линча
- при развитии у пациентки рака эндометрия в возрасте до 50 лет
2) Подозрение на синдром Линча у пациентов, не отвечающих критериям Amsterdam. При соответствии критериям Bethesda (приложение C) выполняется тестирование на MSI, при выявлении MSI-H - тестирование на мутации в генах MLH1, MSH2, MSH6, PMS2.
3) Подозрение на семейный аденоматоз - тестирование на мутацию гена APC:
- при наличии у пациента более 20 полипов кишечника
- при наличии у пациента родственника первой линии с установленным диагнозом семейного аденоматоза
4) Подозрение на наличие аттенуированной формы семейного аденоматоза, MYH-ассоциированный полипоз - тестирование на мутацию APC, мутацию MYH - пациенты, у которых выявлено более 20 полипов толстой кишки, но с отрицательным анализом на мутацию APC:
- пациенты, у которых в семье прослеживается рецессивное наследование семейного аденоматоза;
- пациенты, у которых полипы выявляются в более позднем возрасте (34 - 44 лет). [2]
Уровень убедительности рекомендаций B (уровень достоверности доказательств - IIb)
Комментарии: За исключением MYH-ассоциированного полипоза и синдрома Блума, все наследственные синдромы, связанные с развитием колоректального рака, носят аутосомно-доминантный характер. При наличии яркого семейного анамнеза злокачественных заболеваний пациентам с исключенным семейным аденоматозным полипозом и синдромом Линча показана консультация генетика для потенциального выявления более редких заболеваний: синдромов Пейтца-Егерса, Ли-Фраумени, Блума, Коудена, ювенильного полипоза, олигодонтии и колоректального рака [2].
- Рекомендуется проводить гистологическое исследование хирургически удаленного опухолевого препарата, при этом в морфологическом заключении рекомендуется отразить следующие параметры:
1. Расстояние до проксимального и дистального краев резекции;
2. Размеры опухоли;
3. Гистологическое строение опухоли;
4. Степень дифференцировки опухоли;
5. pT;
6. pN (с указанием общего числа исследованных и пораженных лимфоузлов);
7. Наличие поражения проксимального края резекции (отрицательный результат также должен быть констатирован);
8. Наличие поражения дистального края резекции (отрицательный результат также должен быть констатирован);
9. Наличие поражения латерального края резекции (отрицательный результат также должен быть констатирован);
10. Наличие лимфоваскулярной, периневральной инвазии (отрицательный результат также должен быть констатирован);
11. Степень регрессии опухоли по шкалам Mandard/Dworak (при наличии предшествующего комбинированного лечения);
12. Поражение апикального лимфатического узла (отрицательный результат также должен быть констатирован).
Уровень убедительности рекомендаций C (уровень достоверности доказательств - IV)
3. Лечение
- Рекомендуется рассматривать хирургическое вмешательство как основной метод радикального лечения больных раком прямой кишки.
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - IV)
Комментарии: по показаниям дополнительно проводится адъювантная/неоадъювантная химиотерапия.
- При раннем раке прямой кишки 0 - I стадии (Tis-T1sm1-sm2N0M0) рекомендуется выполнять хирургическое лечение методом трансанального полнослойного эндоскопического удаления опухоли [48 - 50].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - Ia)
Комментарии: Особенность - благоприятный прогноз (5-летняя выживаемость более 90%) и возможность применения органосохранных и функционально-щадящих способов лечения с высокой эффективностью.
Показания к проведению органосохранного лечения:
- размеры опухоли < 3 см,
- поражение не более 30% окружности кишки,
- подвижность образования,
- умеренно- или высокодифференцированная аденокарцинома.
Трансанальная эндоскопическая резекция (TEO, TEM, TAMIS) должна сопровождаться полнослойным иссечением стенки кишки с прилежащей мезоректальной клетчаткой и последующим ушиванием оставшегося дефекта.
При выявлении после морфологического исследования удаленной трансанально опухоли факторов негативного прогноза выполняется стандартная операция с тотальной мезоректумэктомией (ТМЭ). Факторы негативного прогноза:
- стадия >= pT1sm3,
- поражение краев резекции,
- сосудистая или периневральная инвазия,
- низкодифференцированная или слизистая аденокарцинома
Адъювантная терапия не проводится.
- При раннем локализованном раке прямой кишки (T1sm3-T2-3bN0M0) рекомендуется выполнение тотальной или частичной мезоректумэктомии без предоперационного лечения [61, 62].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - III)
Комментарии: Основной вид лечения - хирургический, без использования комбинированных методов. Объем операции - тотальная или частичная мезоректумэктомия в зависимости от локализации опухоли. Адъювантная химиотерапия не проводится. При выявлении после операции
- поражения опухолью циркулярного края резекции,
- pT1-3N1-2
назначается послеоперационная химиолучевая терапия. Дистанционная конформная лучевая терапия проводится ежедневно с РОД 2 Гр, СОД 44 Гр на зоны регионарного метастазирования, включая пресакральные, параректальные, обтураторные, внутренние подвздошные, нижние брыжеечные лимфоузлы. На ложе удаленной опухоли, без перерыва в лечении, СОД составляет 50 Гр в комбинации с фторпиримидинами. При условии выполнения операции в референсном центре и подтверждении в морфологическом заключении удовлетворительного/высокого качества мезоректумэктомии возможно отказаться от проведения послеоперационной химиолучевой терапии. При выявлении поражения регионарных лимфатических узлов также проводится адъюватная химиотерапия.
- При локализованном и местнораспространенном раке прямой кишки II - III стадий (T1-2N1-2M0, T3-4N0-2M0, T2N0M0 при нижнеампулярной локализации опухоли) рекомендуется проведение предоперационной лучевой/химиолучевой терапии и последующего радикального хирургического лечения в объеме тотальной или парциальной мезоректумэктомии [26, 51].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - Ia)
Комментарии: При локализации опухоли в среднеампулярном отделе и отсутствии вовлечения циркулярных краев резекции (на основании данных МРТ) возможны два варианта предоперационной терапии:
1) курс дистанционной конформной лучевой терапии. РОД на первичную опухоль и зону регионарного метастазирования 5 Гр, 5 фракций до СОД 25 Гр в течение 5 последовательных дней с последующим хирургическим лечением в течение 3 дней; допустимо увеличение временного интервала перед операцией до 4 - 6 недель;
2) курс дистанционной конформной лучевой терапии в комбинации с химиотерапией фторпиримидинами. Лучевая терапия РОД 2 Гр, СОД 44 Гр на зоны регионарного метастазирования. СОД 50 - 54 Гр на первичную опухоль. Лечение ежедневно, 5 раз в неделю, фотонами 6 - 18 МэВ (см. раздел 4.3). Хирургическое вмешательство планируется через 6 - 8 недель после окончания курса химиолучевой терапии.
3) в условиях специализированных клиник у пациентов локализацией опухоли в средневерхнеампулярном отделе прямой кишки с поражением <= 3 лимфатических узлов по данным МРТ размерами менее 10 мм и невовлеченнной мезоректальной фасцией допустимо выполнение хирургического лечения без предоперационной лучевой/химиолучевой терапии.
При подозрении на вовлечение потенциальных циркулярных краев резекции по данным предоперационного обследования (МРТ) или низко расположенных опухолях, показан курс дистанционной конформной лучевой терапии в комбинации с химиотерапией фторпиримидинами. Лучевая терапия РОД 2 Гр, СОД 44 Гр на зоны регионарного метастазирования. СОД 54 Гр на первичную опухоль. Лечение ежедневно, 5 раз в неделю, фотонами 6 - 18 МэВ. Хирургическое вмешательство планируется через 6 - 8 недель после окончания курса химиолучевой терапии. У пациентов старческого возраста с тяжелыми сопутствующими заболеваниями допустимо проведение дистанционной конформной лучевой терапии РОД 5 Гр, СОД 25 Гр в течение 5 последовательных дней с пролонгированным интервалом (6 - 10 недель) до оценки эффекта и решения вопроса о проведении хирургического вмешательства. В случаях предоперационного химиолучевого лечения, назначение адъювантной химиотерапии основано на результатах патоморфологического исследования. При ypT3-4N0 или ypT1-4N+ проводится адъювантная химиотерапия по схеме XELOX или FOLFOX, суммарно до 6 месяцев терапия (включая и длительность предоперационного лечения). При ypT1-2N0 проводится адъювантная химиотерапия фторпиримидинами в монорежиме (в случае отсутствия высокого уровня микросателлитной нестабильности в опухоли). При ypT0N0 адъювантная химиотерапия не проводится. При pT1-3N1-2 в случае, если лучевая терапия не была проведена до операции, она проводится после хирургического вмешательства (курс дистанционной конформной лучевой терапии в комбинации с химиотерапией фторпиримидинами). Лучевая терапия РОД 2 Гр, СОД 44 Гр на зоны регионарного метастазирования. СОД 54 Гр на первичную опухоль. Лечение ежедневно, 5 раз в неделю, фотонами 6 - 18 МэВ в самостоятельном виде (при pT3N0), на фоне приема капецитабина и введений фторурацила. Адъювантная химиотерапия в таком случае назначается по рекомендациям лечения рака ободочной кишки. При условии выполнения операции в референсном центре и подтверждении в морфологическом заключении удовлетворительного/высокого качества мезоректумэктомии возможно отказаться от проведения послеоперационной химиолучевой терапии.
- При нерезектабельном раке прямой кишки (T4N0-2M0) рекомендуется проведение мелкофракционной дистанционной конформной лучевой терапии в комбинации с химиотерапией фторпиримидинами и последующей повторной оценкой резектабельности в условиях специализированных учреждений [21, 26, 52].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - IIb)
Комментарии: Вколоченные неподвижные опухоли, врастающие в окружающие органы и ткани, когда исходная возможность выполнения резекции в объеме R0 сомнительна. Лучевая терапия РОД 2 Гр, СОД 44 Гр на зоны регионарного метастазирования. СОД 54 Гр на первичную опухоль. При технической доступности использования линейных ускорителей в режиме многопольного облучения с защитой окружающих тканей IMRT, VMAT СОД может быть увеличена до 58 Гр. Лечение ежедневно, 5 раз в неделю, фотонами 6 - 18 МэВ. При отсутствии осложнений 3 - 4 степени возможно дополнительное проведение химиотерапии по схеме CapOX во время интервала до хирургического лечения. Через 10 - 12 недель после окончания курса химиолучевой терапии повторно выполняется МРТ малого таза, оценивается операбельность опухоли. Если резектабельности опухоли не достигнуто допустимо назначение полихимиотерапии в режиме Capox 4 - 6 курсов с последующей МРТ малого таза для оценки эффекта. В случае осложненного течения со стороны первичной опухоли (кровотечение, непроходимость, наличие связанных с опухолью свищей), перед химиолучевой терапией необходимо рассмотреть вопрос о колостомии/стентировании прямой кишки, как альтернативы паллиативной резекции прямой кишки. Дальнейшие варианты лечения включают попытку радикального хирургического лечения, паллиативное хирургическое лечение, паллиативную лекарственную терапию. У пациентов старческого возраста с тяжелыми сопутствующими заболеваниями допустимо проведение дистанционной конформной лучевой терапии РОД 5 Гр, СОД 25 Гр в течение 5 последовательных дней с пролонгированным интервалом (6 - 10 недель) до оценки эффекта и решения вопроса о проведении хирургического вмешательства. С целью увеличения шанса резектабельности после химиолучевой терапии возможно проведение системной химиотерапии.
- При генерализованном раке прямой кишки с резектабельными/потенциально резектабельными синхронными метастазами в печень или легкие (M1a) рекомендуется выполнять хирургическое вмешательство в объеме R0, как только метастазы станут резектабельными [53 - 55].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - IIb)
Комментарии: При исходной возможности выполнения R0 резекции метастазов рака прямой кишки в печень или легкие, а также при переходе метастатического поражения этих органов в резектабельное состояние в процессе химиотерапевтического лечения проведение хирургического лечения в объеме R0 может обеспечить 5-летнюю выживаемость у 30 - 50% пациентов. Все больные с изолированным метастатическим поражением печени/легких на долечебном этапе должны обсуждаться совместно с торакальными хирургами/хирургами-гепатологами.
Хирургическое вмешательство в объеме R0 необходимо выполнять, как только метастазы станут резектабельными. Пролонгация химиотерапии может приводить к повышению частоты токсических поражений печени, а также к "исчезновению" части метастазов, что затрудняет их идентификацию хирургом во время резекции. Радиочастотная аблация (РЧА) метастазов в печень или стереотаксическое лучевое воздействие может применяться как дополнение к резекции для достижения радикальности вмешательства, так и самостоятельно при невозможности хирургического лечения. Добавление моноклональных антител к химиотерапии не показано при резектабельных метастазах, так как может ухудшать отдаленные результаты. В то же время при потенциально резектабельных очагах, когда в случае объективного ответа есть шанс выполнить R0/R1 резекцию, их применение оправдано). При близком расположении метастатических очагов в печени к магистральным структурам, высоком риске их прогрессирования и перехода в нерезектабельное состояние на первом этапе лечения, по решению консилиума, возможно хирургическое вмешательство на печени (при условии отсутствия симптомов со стороны первичной опухоли). Для остальных пациентов тактика лечения зависит от исходной стадии cTN.
a. cT1-2N0 - показано проведение системной химиотерапии двойными комбинациями (FOLFOX/XELOX). После 4 - 6 курсов лечения выполняется одновременное или последовательное удаление метастазов и первичной опухоли. Альтернативой может являться проведение хирургического этапа лечения (удаление метастазов и первичной опухоли). В дальнейшем, при pT1-2N0 проводится адъювантная химиотерапия двойными комбинациями, с включением фторпиримидинов и оксалиплатина** (FOLFOX, XELOX) до общей продолжительности 6 месяцев.
b. cT1-3N1-2. При опухолях, расположенных в средне- и верхнеампулярном отделах (6 - 15 см) на первом этапе возможно применение следующих подходов:
а) предоперационной лучевой терапии в самостоятельном варианте (дистанционная конформная лучевая терапия РОД на первичную опухоль и зону регионарного метастазирования 5 Гр, 5 фракций до СОД 25 Гр в течение 5 последовательных дней с последующей химиотерапией двойными комбинациями на протяжении 3 месяцев. Далее проводится контрольное обследование и хирургическое лечение.
б) химиолучевой терапии (дистанционная конформная лучевая терапия РОД 2 Гр, СОД 44 Гр на зону регионарного метастазирования. СОД 54 Гр на первичную опухоль). Лечение ежедневно, 5 раз в неделю, фотонами 6 - 18 МэВ на фоне монохимиотерапии фторпиримидинами. При отсутствии осложнений 3 - 4 степени в дальнейшем проводится химиотерапия двойными комбинациями на протяжении 3 месяцев. Далее проводится контрольное обследование и хирургическое лечение.
в) при высокорасположенных опухолях cT1-2 или T3 с инвазией не более 5 мм и единичных N+ можно отказаться от проведения лучевой терапии, ограничившись химиотерапией (до операции проводится 4 - 6 курсов лечения двойными комбинациями (FOLFOX, XELOX).
После завершения предоперационной терапии одновременно или последовательно с удалением первичной опухоли проводится хирургическое удаление метастазов. Решение о проведении симультанной операции должно приниматься консилиумом с участием хирурга-онкопроктолога, хирурга-гепатолога или торакального хирурга, терапевта, анестезиолога, реаниматолога. В дальнейшем проводится адъювантная химиотерапия двойными комбинациями, с включением фторпиримидинов и оксалиплатина** (FOLFOX, XELOX) до общей продолжительности 6 месяцев.
c. При низко расположенных (ниже 5 см) опухолях обязательно включение в план лечения дистанционной конформной лучевой терапии в комбинации с химиотерапией фторпиримидинами. Лучевая терапия РОД 2 Гр, СОД 44 Гр на зону регионарного метастазирования. СОД 54 Гр на первичную опухоль. Лечение ежедневно, 5 раз в неделю, фотонами 6 - 18 МэВ (см. раздел 3.2). Хирургическое лечение проводится не ранее 8 недель после завершения химиолучевой терапии. При отсутствии осложнений 3 - 4 степени возможно дополнительное проведение химиотерапии двойными комбинациями во время интервала до хирургического лечения. Возможно начало терапии и с химиотерапии двойными комбинациями для контроля отдаленных метастазов (проводится 4 - 6 курсов лечения двойными комбинациями (FOLFOX, XELOX), а лучевую терапию провести после нее. После завершения предоперационной терапии одновременно или последовательно с удалением первичной опухоли проводится хирургическое удаление метастазов. В дальнейшем проводится адъювантная химиотерапия двойными комбинациями, с включением фторпиримидинов и оксалиплатина** (FOLFOX, XELOX) до общей продолжительности 6 месяцев.
d. cT4 - показано проведение пролонгированной дистанционной конформной лучевой терапии РОД 2 Гр, СОД 44 Гр на зону регионарного метастазирования, СОД 54 - 60 Гр на первичную опухоль. Лечение ежедневно, 5 раз в неделю, фотонами 6 - 18 МэВ на фоне химиотерапии фторпиримидинами. Возможно начало терапии и с химиотерапии двойными комбинациями для контроля отдаленных метастазов, продолжив химиолучевую терапию после. В случае эффекта со стороны первичной опухоли показано, в зависимости от состояния больного и объема вмешательства, симультанное или последовательное хирургическое вмешательство. В случае осложненного течения со стороны первичной опухоли (кровотечение, непроходимость, наличие связанных с опухолью свищей), перед химиолучевой терапией необходимо рассмотреть вопрос о колостомии/стентировании прямой кишки, как альтернативы паллиативной резекции прямой кишки. У пациентов старческого возраста с тяжелыми сопутствующими заболеваниями допустимо проведение дистанционной конформной лучевой терапии РОД 5 Гр, СОД 25 Гр в течение 5 последовательных дней с пролонгированным интервалом (6 - 10 недель) до оценки эффекта и решения вопроса о проведении хирургического вмешательства.
- При генерализованном раке прямой кишки с нерезектабельными синхронными метастазами рекомендуется проведение максимально эффективной химиотерапии, задачей которой является достижение объективного эффекта и перевод нерезектабельных метастазов в резектабельные. [38, 63]
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - Ia)
Комментарии: Показано применение двойных комбинаций (FOLFOX, XELOX или FOLFIRI). В случае отсутствия мутации RAS возможно добавление к режимам химиотерапии FOLFIRI или FOLFOX (но не XELOX или FLOX) анти-EGFR моноклональных антител, что позволяет увеличить частоту выполнения R0-резекций печени. Альтернативой является добавление бевацизумаба** к любому двойному режиму химиотерапии (вне зависимости от мутации RAS), что повышает частоту выраженного лекарственного патоморфоза по сравнению с одной химиотерапией. Другой возможной опцией повышения резектабельности является применение "тройной" комбинации FOLFOXIRI, к которой возможно добавление МКА, однако более высокая токсичность режима требует осторожности при его назначении. Внутриартериальная химиотерапия остается экспериментальным методом и не рекомендуется к рутинному применению в первой линии терапии. Различные методы эмболизации печеночной артерии, внутриартериальная химиотерапия могут применяться у отдельных пациентов с изолированным или преобладающим метастатическим поражением печени при исчерпанности возможностей системной терапии. Больные, у которых ответ на лечение недостаточен для перевода опухоли в резектабельное состояние, подлежат паллиативному лекарственному лечению. Вопрос об удалении первичной опухоли решается индивидуально с учетом риска развития связанных с ней осложнений. При условии хорошего ответа на проводимую терапию проводится повторная оценка резектабельности метастатических очагов.
- Рекомендуется всех больных с изолированным метастатическим поражением печени/легких на долечебном этапе обсуждать совместно с торакальными хирургами/хирургами-гепатологами. [38, 64]
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - IIa)
Комментарии: Тактика лечения зависит от исходной резектабельности метастатических очагов. Наилучших результатов возможно добиться при достижении края резекции не менее 1 см [22]. Операцию в объеме R0 необходимо выполнять, как только метастазы станут резектабельными. Пролонгация химиотерапии может приводить к повышению частоты токсических поражений печени, а также к "исчезновению" части метастазов, что затрудняет их идентификацию хирургом во время резекции. При наличии симптомной первичной опухоли (угрозе кишечной непроходимости/кровотечения) на первом этапе проводится хирургическое удаление первичной опухоли с лимфодиссекцией. Радиочастотная аблация метастазов в печень или стереотаксическое лучевое воздействие может стать как дополнением к резекции печени для достижения радикальности вмешательства, так и самостоятельным методом при невозможности хирургического лечения [23]. Внутриартериальная химиотерапия остается экспериментальным методом и не рекомендована к рутинному применению в первой линии терапии.
- При метахронных резектабельных или потенциально резектабельных метастазах рака прямой кишки в печень или легкие рекомендуется проведение хирургического лечения с послеоперационной химиотерапией двойными (FOLFOX, XELOX) комбинациями препаратов. [38, 65]
Уровень убедительности рекомендаций - II (уровень достоверности доказательств - IIb)
Комментарии: При исходной возможности выполнения R0 резекции метастазов рака прямой кишки в печень или легкие, а также при переходе метастатического поражения этих органов в резектабельное состояние в процессе химиотерапевтического лечения проведение хирургического лечения в объеме R0 может обеспечить 5-летнюю выживаемость у 30 - 50% пациентов. Альтернативой данному подходу является проведение периоперационной (около 3 мес. терапии FOLFOX или XELOX до резекции печени и столько же после нее) химиотерапии. При распространенном опухолевом процессе в печени, делающем невозможным/сомнительным выполнение R0-резекции, показано проведение максимально активной терапии для перевода этих метастазов в резектабельные. Обычно применяют двойные комбинации химиопрепаратов (FOLFOX, XELOX, FOLFIRI) с возможным добавлением (принципы лечения указаны выше) МКА.
- При исходно резектабельных метастатических очагах после успешного проведения R0 или R1 резекции рекомендуется проведение адъювантной химиотерапии. [38, 65]
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - IIb)
Комментарии: альтернативой немедленному хирургическому лечению является проведение периоперационной системной химиотерапии (FOLFOX, XELOX). После 4 - 6 циклов выполняется одновременное или последовательное удаление метастазов и первичной опухоли, а после операции продолжается проводимая ранее химиотерапия до суммарной продолжительности 6 месяцев. Добавление моноклональных антител к химиотерапии при резектабельных метастазах в печень не показано, так как может ухудшать отдаленные результаты.
- При потенциально резектабельных синхронных и метахронных метастатических очагах рекомендуется проведение максимально активной химиотерапии, задачи которой - достижение объективного эффекта и перевод нерезектабельных метастазов в резектабельные (FOLFOX, XELOX или FOLFIRI). [38, 66].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - IIb)
- При потенциально резектабельных метастатических очагах в случае отсутствия мутации RAS (мутация в гене BRAF при раке прямой кишки - явление казуистическое) рекомендуется добавление к режимам химиотерапии FOLFIRI или FOLFOX анти-EGFR МКА (цетуксимаб** или панитумумаб**) либо бевацизумаба**. [38, 67]
Уровень убедительности рекомендаций - II (уровень достоверности доказательств - IIb)
- При потенциально резектабельных метастатических очагах при наличии мутации RAS рекомендовано добавление бевацизумаба** к любому из указанных выше режимов химиотерапии. Другой возможной опцией повышения резектабельности является применение "тройной" комбинации FOLFOXIRI, к которой возможно добавление МКА [24, 25]. После 4 - 6 циклов выполняется повторная оценка резектабельности, при отсутствии прогрессирования одновременное или последовательное удаление метастазов и первичной опухоли. Далее - адъювантная химиотерапия по программе FOLFOX или XELOX до суммарной продолжительности 6 мес. (с учетом предоперационной химиотерапии). В случае прогрессирования/невозможности удаления метастатических очагов лечение проводится по принципам, указанным в пункте лечения больных с нерезектабельными метастазами. [38]
Комментарии: В случае назначения таргетных препаратов, после перевода метастазов в операбельное состояние и выполнения R0-резекции метастатических очагов, проводится химиотерапия до суммарной продолжительности 6 месяцев. Анти-EGFR антитела, бевацизумаб** и иринотекан** следует в послеоперационном периоде отменить. При R1 резекции - возможно продолжение предоперационной комбинации химиопрепаратов и МКА до суммарной продолжительности 6 месяцев [38, 68, 69].
Уровень убедительности рекомендаций - I (уровень достоверности доказательств - Ib)
- При функционально неоперабельном раке прямой кишки (на фоне тяжелой сопутствующей патологии) рекомендуется проведение паллиативного лекарственного лечения либо симптоматической терапии. Возможно стентирование опухоли или формировании разгрузочной кишечной стомы.
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - IV)
Комментарии: Риск проведения операции превышает риск, связанный с прогрессированием онкологического заболевания. Решение о наличии противопоказаний к хирургическому лечению может приниматься только на консилиуме с участием хирурга, терапевта, анестезиолога, реаниматолога. Больные данной группы подлежат паллиативному лекарственному лечению либо симптоматической терапии. Возможно стентирование опухоли или формировании разгрузочной кишечной стомы.
- При рецидиве рака прямой кишки рекомендовано проведение предоперационной дистанционной конформной лучевой терапии РОД 2 Гр, СОД 44 Гр на зону регионарного метастазирования, СОД 54 - 58 Гр на зону рецидива (в случае, если лучевая терапия не проводилась ранее), затем рассмотреть возможность повторного хирургического лечения, при невозможности проведения повторного хирургического лечения рекомендована системная химиотерапия. [26]
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - IIb)
Комментарии: Даже если пациенту ранее проводилась лучевая терапия, необходимо рассмотреть вопрос о возможности дополнительного облучения или локального стереотаксического лучевого воздействия. Операцию выполняют через 10 - 12 недель после химиолучевой терапии. В случае невозможности проведения лучевой терапии и выполнения хирургического вмешательства проводят паллиативную химиотерапию.
Выбор лечебной тактики осуществляется на мультидисциплинарном консилиуме с участием хирурга-проктолога, гепатохирурга, лучевого терапевта и химиотерапевта, на основании результатов дооперационного обследования с определением клинической стадии заболевания.
3.1 Хирургическое лечение
- Рекомендуется перед операцией у всех больных раком прямой кишки получить информированное согласие на проведение хирургического вмешательства и формирование колостомы (даже если это не предполагается в плане операции).
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - IV)
- Рекомендуется при технической доступности и при наличии квалифицированной хирургической бригады в специализированных клиниках проводить хирургическое лечение рака прямой кишки лапароскопическим доступом [28 - 31].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - Ib)
Комментарии: лапароскопические резекции прямой кишки имеют ряд преимуществ, включая раннюю реабилитацию пациентов, снижение частоты развития и выраженности спаечного процесса, меньшее использование опиоидных анальгетиков, снижение сроков госпитализации, меньший риск развития послеоперационных грыж [28 - 31].
- Рекомендуется при наличии противопоказаний к формированию первичного анастомоза выполнять операцию Гартмана.
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - IV)
- Рекомендуется выполнять следующие стандартные объемы оперативных вмешательств у больных раком прямой кишки: чрезбрюшная резекция прямой кишки, низкая чрезбрюшная резекция прямой кишки, брюшно-анальная резекция прямой кишки, операция Гартмана, брюшно-промежностная экстирпация прямой кишки. Мобилизация прямой кишки должна выполняться только острым путем (в том числе с использованием электрохирургических и ультразвуковых инструментов высокой энергии) с соблюдением принципов тотальной или частичной мезоректумэктомии (необходим удаление мезоректума не менее 5 см дистальнее опухоли) с сохранением тазовых вегетативных нервов. Формирование колоректального анастомоза предпочтительно делать с использованием циркулярного сшивающего аппарата, для пересечения кишки - использовать линейно-режущие сшивающие аппараты [57, 58].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - IIb)
Комментарии: При распространении опухоли за пределы мезоректальной фасции показано экстрафасциальное удаление прямой кишки. При выполнении мультивисцеральных резекций для рассечения тканей предпочтительно использовать электрохирургические и ультразвуковые инструменты с целью уменьшения кровопотери. Дистальная граница резекции должна составлять не менее 2 см по стенке кишки и не менее 5 см по мезоректальной клетчатке из-за риска ретроградного лимфогенного метастазирования.
Нижняя брыжеечная артерия должна быть лигирована непосредственно под местом отхождения левой ободочной артерии. Более высокая перевязка питающего сосуда не влияет на отдаленные результаты лечения, однако допускается, с раздельной высокой перевязкой нижней брыжеечной артерии и вены при необходимости мобилизации левого изгиба. При этом следует сохранять преаортальное и нижнее брыжеечное вегетативные нервные сплетения. Рутинное выполнение расширенной аорто-подвздошно-тазовой лимофодиссекции не рекомендуется. При выполнении тотальной мезоректумэктомии (локализация опухоли ниже 10 см от края ануса) рекомендуется формировать превентивную коло- или илеостому. После тотальной мезоректумэктомии операция может завершаться формированием тазового толстокишечного резервуара или анастомоза "бок-в-конец" для улучшения функциональных результатов лечения.
Выполнение экстралеваторной экстирпации прямой кишки показано пациентам с подтвержденным МРТ врастанием опухоли в мышцы тазового дна.
- Рекомендуется у пациентов с кишечной непроходимостью, вызванной раком прямой кишки, ограничивать хирургическое лечение формированием двуствольной трансверзо- или сигмостомы с целью проведения последующего комбинированного лечения.
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - IV)
Комментарии: У пациентов с кровотечением и перфорацией, вызванными раком прямой кишки, показано выполнение оперативного вмешательства с соблюдением принципов тотальной мезоректумэктомии. При других осложнениях опухолевого процесса предпочтение следует отдавать формированию временной или постоянной кишечной стомы. В отдельных случаях, при условии наличия в клинике должного опыта и оборудования, разрешение непроходимости возможно путем стентирования с последующей подготовкой пациента к плановому хирургическому или комбинированному лечению.
3.2. Комбинированное лечение
- При лечении рака прямой кишки cT3N0 или cT1-3N1-2 с локализацией в среднеампулярном отделе и отсутствии поражения потенциального циркулярного края резекции по данным МРТ рекомендуется рассмотреть возможность проведения курса дистанционной конформной лучевой терапии. РОД на первичную опухоль и зону регионарного метастазирования 5 Гр, 5 фракций до СОД 25 Гр в течение 5 последовательных дней с последующим хирургическим лечением в течение 3 дней или через 4 - 6 недель в качестве альтернативы пролонгированному курсу химиолучевой терапии.
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - IV)
Комментарии: При технической доступности возможно дополнение курса лучевой терапии использованием локальной гипертермии в дни 3; 4; 5 при температуре 41 - 43 °C в течение 60 мин.
- Рекомендуется при подозрении на вовлечение потенциального циркулярного края резекции по данным предоперационного обследования или низко расположенных опухолях проведение пролонгированной химиолучевой терапии (дистанционной конформной лучевой терапии в комбинации с химиотерапией) [59, 60].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - Ia)
Комментарии: Лучевая терапия РОД 2 Гр, СОД 44 Гр на зону регионарного метастазирования. СОД 54 Гр на первичную опухоль. Лечение ежедневно, 5 раз в неделю, фотонами 6 - 18 МэВ на фоне химиотерапии фторпиримидинами. При технической доступности возможно дополнение курса лучевой терапии использованием локальной гипертермии после СОД 16 Гр 2 раза в неделю с интервалом 72 часа при температуре 41 - 43 °C в течение 60 минут, всего 4 - 5 сеансов. Хирургическое вмешательство проводится через 6 - 8 недель после завершения химиолучевой терапии. Объем облучения на зону регионарного метастазирования должен включать пресакральные, параректальные, обтураторные, внутренние подвздошные, нижние брыжеечные лимфоузлы. Начинается дистанционная лучевая терапия с объемного ЗИ-планирования и выполняется по технологии конформной лучевой терапии. Предлучевая топометрическая подготовка включает в себя выполнение КТ и МРТ исследований, на основании чего формируется план облучения. Точность воспроизведения условий лучевой терапии контролируется с помощью системы портальной визуализации. Возможно проведение лучевой терапии на протонных ускорителях энергией 70 - 250 МэВ с использованием протонных комплексов.
Добавление в режимы химиолучевой терапии оксалиплатина**, иринотекана** и моноклональных антител не улучшает результаты.
При местно-распространенных неоперабельных опухолях (cT4N0-2) на первом этапе обязательно проводится одновременная химиолучевая терапия (50 - 54 Гр по 2 Гр за фракцию на фоне терапии фторпиримидинами. Хирургическое вмешательство проводится через 6 - 8 недель после завершения химиолучевой терапии в случае объективного ответа. Возможные варианты химиотерапии представлены в таблице 3.
Таблица 3.
Режимы фторпиримидинов, применяемые в одновременной химиолучевой терапии рака прямой кишки.
Схема химиотерапии
Препарат
Доза
Путь введения
Дни приема
Длительность цикла, дни
Количество циклов
1
Непрерывная инфузия фторурацила**
225 мг/м2
в/в непрерывно
5 (в дни лучевой терапии) или 7 дней в неделю в зависимости от переносимости
на протяжении всей лучевой терапии
на протяжении всей лучевой терапии
2
Капецитабин**
8825 мг/м2 2 раза в сутки
внутрь
В сравнении с послеоперационной химиолучевой терапией эффективность предоперационной химиолучевой терапии выше, а токсичность меньше, поэтому применение послеоперационной лучевой терапии (54 Гр по 2 Гр за фракцию на фоне терапии фторпиримидинами (табл. 1)) допустимо только у пациентов, которым по каким-либо причинам такое лечение не было выполнено на дооперационном этапе или при выявлении положительного циркулярного края резекции после хирургического лечения (II, A).
В случае, когда пациенту показано проведение и адъювантной химиотерапии (T1-4N1-2) возможны два варианта лечения:
1. (предпочтительнее) проведение 2 мес. адъювантной химиотерапии (см. раздел 3.3), далее химиолучевой терапии (54 Гр по 2 Гр за фракцию на фоне терапии фторпиримидинами (табл. 1)) с последующими 2 месяцами адъювантной химиотерапии. Общая продолжительность данного лечения должна составлять 6 месяцев.
2. Допустимо проведение химиолучевой терапии (54 Гр по 2 Гр за фракцию на фоне терапии фторпиримидинами (табл. 1)) с последующей адъювантной химиотерапией до общей продолжительности лечения 6 месяцев.
3.3 Адъювантная химиотерапия
- Рекомендовано назначать адъювантную химиотерапию в зависимости от проведения предоперационной химиолучевой терапии. В случаях предоперационного химиолучевого лечения, назначение адъювантной химиотерапии основано на результатах патоморфологического исследования. При ypT3-4N0 или ypT1-4N+ проводится адъювантная химиотерапия по схеме XELOX или FOLFOX, суммарно до 6 месяцев терапии (включая и длительность предоперационного лечения). При ypT1-2N0 проводится адъювантная химиотерапия фторпиримидинами в монорежиме (в случае отсутствия высокого уровня микросателлитной нестабильности в опухоли). При ypT0N0 адъювантная химиотерапия не проводится. При pT3-4N0 или pT1-3N1-2 в случае, если лучевая терапия не была проведена до операции, адъювантная химиотерапия в таком случая назначается по рекомендациям лечения рака ободочной кишки [21].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - Ia)
Комментарии: общая продолжительность адъювантной химиотерапии составляет 6 месяцев. Обнаруженная микросателлитная нестабильность опухоли при II стадии свидетельствует о хорошем прогнозе и проведение химиотерапии, как правило, не требуется при условии отсутствия pT4N0. Минимальный объем химиотерапии при III стадии включает в себя фторпиримидины, которые можно применять в различных вариантах: струйно (режим клиники Мейо, Roswell Park), инфузионный (режимы De Gramount, AIO) или перорально (капецитабин**) (табл. 4). Оптимальный объем адъювантной химиотерапии при III стадии включает комбинацию оксалиплатина** с фторпиримидинами в течение 6 месяцев. Наиболее оптимальными являются режимы FOLFOX или XELOX. Комбинация оксалиплатина** со струйным фторурацилом** (режим FLOX) обладает схожей эффективностью, но сопряжена с высокой токсичностью (табл. 4). При развитии симптомов полинейропатии 2 - 3 монотерапия фторпиримидинами. В адъювантной терапии колоректального рака не должны применяться иринотекан** и моноклональные антитела, в частности, бевацизумаб** и цетуксимаб** включение которых в режимы химиотерапии по результатам рандомизированных исследований не приводит к улучшению показателей выживаемости [21]. Даже если в результате проведенного предоперационного химиолучевого лечения имеет место уменьшение стадии вследствие объективного эффекта, необходимо проводить адъювантную химиотерапию, исходя из данных предоперационного стадирования. Общая продолжительность адъювантной химиотерапии, включая пред- или послеоперационную химиолучевую терапию, должна составлять 6 месяцев.
Таблица 4 - Режимы фторпиримидинов, применяемые в лечении колоректального рака
Режим
Схема
Клиники Мейо
Кальция фолинат** 20 мг/м2 в/в струйно с последующим болюсом ФУ** 42 <...> мг/м2, 1 - 5 дни.
Начало очередного курса на 29-й день.
Roswell Park
Кальция фолинат** 500 мг/м2 в/в 2-часовая инфузия с последующи <...> болюсом ФУ** 500 мг/м2.
Еженедельно в течение 6 недель с последующим 2-недельным перерывом.
AIO
Кальция фолинат** 500 мг/м2 в/в в течение 2 часов с последующей 2 <...> часовой инфузией ФУ** 2600 мг/м2.
Еженедельно, длительно.
Модифицированный LV5FU2
(модифицированный режим De Gramont)
Кальция фолинат** 400 мг/м2 в/в в течение 2 часов с последующим болюсом <...> ФУ** 400 мг/м2 и с последующей 46-часовой инфузией ФУ** 2400 мг/м2 (г <...> 1200 мг/м2 в сутки).
Начало очередного курса на 15 день.
Капецитабин**
1250 - 2500 мг/м2 в сутки внутрь 1 - 14 дни. Начало очередного курса на 2 <...> день.
Таблица 5 - Режимы оксалиплатина** и фторпиримидинов, применяемые в лечении колоректального рака
Модифицированный FOLFOX 6
Оксалиплатин** 85 мг/м2 2-часовая инфузия в 1-й день, кальция фолинат** 400 мг/м2 в/в <...> течение 2 часов с последующим болюсом ФУ** 400 мг/м2 в/в струйно и 46-часовой инфузией ФУ* <...> 2400 мг/м2 (по 1200 мг/м2 в сутки). Начало очередного курса на 15-й день
XELOX
Оксалиплатин** 130 мг/м2 в 1-й день, капецитабин** 2000 мг/м2 в сутки 1 - 14 дни. Нача <...> очередного курса на 22-й день
FLOX
Оксалипратин** 85 мг/м2 в течение 2 часов (дни 1; 15 и 29 каждого цикла) + кальция фолинат* <...> 20 мг/м2 в/в струйно и с последующим болюсом ФУ** 500 мг/м2 еженедельно в течение 6 недель <...> последующим 2-недельным перерывом.
3.4 Паллиативная химиотерапия
- Рекомендуется в качестве первой линии терапии у пациентов с малосимптомным процессом (статус ECOG 0 - 1) в отдельных случаях, возможно, назначать монотерапию (табл. 2) фторпиримидинами. При прогрессировании заболевания к режиму рекомендуется добавление оксалиплатина**, а в качестве третьей линии - иринотекан** и фторпиримидины [35 - 37].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - Ib)
- Большему числу пациентов рекомендуются к применению и другие возможные варианты первой линии химиотерапии в виде двойных комбинации препаратов (FOLFOX, XELOX или FOLFIRI) на протяжении не менее 3 - 4 месяцев с последующей возможной поддерживающей терапией фторпиримидинами [38, 70].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - Ia)
Комментарии: оксалиплатин** в монотерапии малоэффективен и должен применяться в комбинации с фторпиримидинами. При прогрессировании после ранее достигнутого эффекта необходимо рассмотреть вопрос о повторном применении ранее эффективного режима.
- У пациентов с клинически значимыми симптомами заболевания (ECOG 1 - 2) с обширной диссеминацией рекомендуется использование в первой линии двойных комбинаций препаратов (FOLFOX, XELOX или FOLFIRI) на протяжении не менее 3 - 4 месяцев с последующей возможной поддерживающей терапией фторпиримидинами [38, 70].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - Ib)
Комментарии: в случае прогрессирования опухолевого процесса после первой линии терапии, вторая линия может быть назначена пациентам с удовлетворительным общим статусом (ECOG <= 2). При рефрактерности к режиму FOLFOX (XELOX) в качестве второй линии обычно назначают режим FOLFIRI или монотерапию иринотеканом**, при рефрактерности к иринотекану** в 1 линии в режиме FOLFIRI - FOLFOX/XELOX (табл. 3; 4) [39]. В случае химиорезистентной опухоли (прогрессирование заболевания в процессе или ближайшее время после окончания терапии с включением иринотекана**, оксалиплатина** и фторпиримидинов) проведение дальнейшей химиотерапии не показано.
- Ослабленным пациентам с ECOG > 2 рекомендуется малотоксичная монохимиотерапия фторпиримидинами или симптоматическая терапия [38].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - IV)
- Рекомендуется к вышеперечисленным режимам добавление МКА (бевацизумаб**, цетуксимаб** или панитумумаб**, что увеличивает продолжительность жизни [40]
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - Ia)
Комментарии: в монотерапии бевацизумаб** малоэффективен. Рекомендуется продолжение терапии бевацизумабом** с фторпиримидинами до прогрессирования заболевания. В случае дальнейшего прогрессирования возможно продолжение бевацизумаба** со сменой режима. На сегодняшний день неизвестны клинические или молекулярные факторы, предсказывающие эффективность бевацизумаба**. Наибольшую активность бевацизумаб** демонстрирует в первой и во второй линиях терапии; добавление бевацизумаба** к режимам на основе оксалиплатина** или иринотекана** во второй линии лечения достоверно увеличивает продолжительность жизни. Во второй линии терапии возможно применение другого антиангиогенного моноклонального антитела - афлиберцепта**. В отличие от бевацизумаба** моноклональные анти-EGFR антитела (цетуксимаб** и панитумумаб**) активны как в монотерапии, так и в комбинации с химиотерапией, но лишь у пациентов с отсутствием мутации RAS (мутация в гене BRAF при раке прямой кишки - явление казуистическое). Анти-EGFR антитела не должны применяться с капецитабином**, режимами FLOX, XELOX. Самостоятельная активность цетуксимаба** и панитумумаба** позволяет рекомендовать их в монотерапии у пациентов в третьей - четвертой линии. Совместное применение бевацизумаба** и анти-EGFR антител ухудшает результаты лечения и не рекомендуется.
Задачи паллиативной химиотерапии - увеличение продолжительности жизни, уменьшение симптомов болезни и улучшение качества жизни. Пациенты, получившие все три активных химиопрепарата (иринотекан**, оксалиплатин** и фторпиримидины), имеют достоверно большую продолжительность жизни. При этом не важно, за сколько линий терапии это удается реализовать. До сих пор четко не ясна оптимальная продолжительность первой линии терапии. Возможные варианты:
1) непрерывная терапия до прогрессирования заболевания или развития неприемлемой токсичности;
2) проведение лечения на протяжении не менее полугода с последующим наблюдением;
3) применение двойной комбинации в течение не менее 3 - 4 мес. с последующей поддержкой фторпиримидинами (стратегия "поддерживающей" терапии имеет преимущества перед полным прекращением лечения). В случае применения комбинации химиотерапии с бевацизумабом**, поддерживающая терапия бевацизумабом** + фторпиримидины должна проводиться до появления признаков прогрессирования болезни или неприемлемой токсичности. При использовании комбинации химиотерапии с анти-EGFR антителами также рекомендуется поддерживающая монотерапия антителами до прогрессирования заболевания [25].
У пациентов с прогрессированием на оксалиплатине**, иринотекане** и фторпиримидинах, бевацизумабе** и анти-EGFR антител (по показаниям), возможно назначение препарата регорафениба**. В случае низкого функционального статуса у пациента начальная доза регорафениба** может быть снижена на 1 курсе.
Табл. 6. Режимы с иринотеканом** и моноклональные антитела, применяемые в лечении колоректального рака.
FOLFIRI
Иринотекан** 180 мг/м2 90-минутная инфузия в 1-й день, кальция фолинат** 400 мг/м2 в/в <...> течение 2 часов с последующим болюсом ФУ** 400 мг/м2 в/в струйно и 46-часовой инфузией ФУ* <...> 2400 мг/м2 (по 1200 мг/м2 в сутки). Начало очередного курса на 15-й день.
FOLFOXIRI*
Иринотекан** 165 мг/м2 90-минутная инфузия в 1-й день, оксалиплатин** 85 мг/м2 2-часовая <...> инфузия в 1-й день, кальция фолинат** 200 мг/м2 в/в в течение 2 часов с последующей 4 <...> часовой инфузией ФУ** 3200 мг/м2. Начало очередного курса на 15-й день.
XELIRI*
Иринотекан** 200 мг/м2 в 1-й день, капецитабин** 1600 - 1800 мг/м2/сутки 1 - 14 дни. Начало <...> очередного курса на 22-й день.
Бевацизумаб**
7,5 мг/кг в/в 90-60-30-минутная инфузия каждые 3 недели, или 5 мг/кг каждые 2 недели в <...> зависимости от применяемого режима химиотерапии).
Афлиберцепт**
4 мг/кг в/в 1-часовая инфузия каждые 2 недели (вместе с режимом FOLFIRI во второй лини <...> терапии)
Цетуксимаб**
400 мг/м2 в/в 1-часовая инфузия в первый день, далее по 250 мг/м2 еженедельно
Панитумумаб**
6 мг/кг в/в 1-часовая инфузия каждые 2 недели.
Рамуцирумаб
8 мг/кг в/в 1-часовая инфузия каждые 2 недели (вместе с режимом FOLFIRI во второй лини <...> терапии)
Регорафениб**
160 мг 1 раз в день р.о. 1 - 21 дни, 1 неделя перерыв
<*> Режим характеризуется более высокой, чем FOLFIRI, частотой развития диареи.
3.5 Симптоматическая терапия
- Пациентам с острым кровотечением рекомендуется выполнить срочное эндоскопическое исследование, системную гемостатическую терапию. В зависимости от результатов исследования производят эндоскопическую остановку кровотечения. При невозможности/неэффективности эндоскопического гемостаза проводится экстренное хирургическое вмешательство.
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - IV)
- При опухолевом стенозе рекомендуется установка саморасправляющегося стента в зону опухолевого стеноза или оперативное лечение (колостомия/илеостомия) [41]
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - IIb)
- В лечении болевого синдрома рекомендуется проведение дистанционной лучевой терапии, медикаментозной терапии, локорегионарной анестезии в зависимости от причины болевого синдрома [72].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - IIb)
- При лечении асцита рекомендуется рассмотреть возможность применения диуретиков и лапароцентеза [73].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - IIb)
Комментарии: целью так называемой "наилучшей поддерживающей терапии" (best supportive care) является профилактика и облегчение симптомов заболевания и поддержание качества жизни пациентов и их близких, независимо от стадии заболевания и потребности в других видах терапии. В случае рака прямой кишки меры, направленные на облегчение основных симптомов, способствуют увеличению продолжительности жизни.
4. Реабилитация
- Рекомендуется проводить реабилитацию, ориентируясь на общие принципы реабилитации пациентов после проведенных хирургических вмешательств и/или химиотерапии.
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - IV)
5. Профилактика
- Рекомендуется соблюдать следующую периодичность и методы наблюдения после завершения лечения по поводу рака прямой кишки:
- В первые 1 - 2 года физикальный осмотр и сбор жалоб рекомендуется проводить каждые 3 - 6 месяцев, на сроке 3 - 5 лет - 1 раз в 6 - 12 месяцев. После 5 лет с момента операции визиты проводятся ежегодно или при появлении жалоб. У больных с высоким риском рецидива перерыв между обследованиями может быть сокращен.
- Объем обследования:
- ![]() Анамнез и физикальное обследование (пальцевое исследование прямой кишки)
Анамнез и физикальное обследование (пальцевое исследование прямой кишки)
- ![]() Онкомаркеры РЭА, СА 19.9 (если были повышены исходно) каждые 3 месяца первые 2 года и далее каждые 6 месяцев в последующие 3 года.
Онкомаркеры РЭА, СА 19.9 (если были повышены исходно) каждые 3 месяца первые 2 года и далее каждые 6 месяцев в последующие 3 года.
- ![]() колоноскопия через 1 и 3 года после резекции первичной опухоли, далее каждые 5 лет с целью выявления метахронной опухоли или удаления обнаруженных полипов толстой кишки. При выявлении полипов колоноскопия выполняется ежегодно (B). В случае если до начала лечения колоноскопия не была выполнена по причине стенозирующей опухоли, она производится через 3 - 6 месяцев после ее резекции
колоноскопия через 1 и 3 года после резекции первичной опухоли, далее каждые 5 лет с целью выявления метахронной опухоли или удаления обнаруженных полипов толстой кишки. При выявлении полипов колоноскопия выполняется ежегодно (B). В случае если до начала лечения колоноскопия не была выполнена по причине стенозирующей опухоли, она производится через 3 - 6 месяцев после ее резекции
- ![]() УЗИ органов брюшной полости и малого таза каждые 3 - 6 месяцев в зависимости от риска прогрессирования;
УЗИ органов брюшной полости и малого таза каждые 3 - 6 месяцев в зависимости от риска прогрессирования;
- ![]() Рентгенография органов грудной клетки каждые 12 месяцев;
Рентгенография органов грудной клетки каждые 12 месяцев;
- ![]() КТ органов грудной и брюшной полости с внутривенным контрастированием
КТ органов грудной и брюшной полости с внутривенным контрастированием
- ![]() однократно в сроки 12 - 18 месяцев после операции
однократно в сроки 12 - 18 месяцев после операции
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - IV)
Комментарии: задачей наблюдения является раннее выявление прогрессирования заболевания с целью раннего начала химиотерапии или хирургического лечения резектабельных метастатических очагов, рецидивных опухолей, а также выявление метахронных опухолей ободочной кишки.
6. Дополнительная информация, влияющая на течение и исход заболевания
Критерии оценки качества медицинской помощи
N
Критерии качества
Уровень достоверности доказательств
Уровень убедительности рекомендаций
1.
Выполнена морфологическая верификация диагноза до начала лечения, за исключением случаев экстренной хирургии
2.
Выполнена оценка факторов риска прогрессирования у больных со II стадией заболевания
3.
Наличие назначения теста на MSI при II стадии болезни
4.
Выполнено определение генов RAS (при метастатической болезни)
5.
В случае если пациенту показано проведение химиотерапии и/или таргетной терапии, то она назначена в соответствии с рекомендациями и при условии наличия в клинике препаратов
6.
В случае, если пациенту показано проведение химиотерапии и/или таргетной терапии и при поражении метастазами только печени перед началом 1 курса химиотерапии выполнена консультация хирурга-гепатолога
7.
В случае, если пациенту показано проведение химиотерапии и/или таргетной терапии, дозы, режим назначения химиопрепаратов и количество курсов проводился в соответствии с рекомендациями, при отсутствии осложнений лечения и при условии наличия в клинике препаратов
8.
В случае, если пациенту показано проведение химиотерапии и/или таргетной терапии, профилактика осложнений химиотерапии проведена в соответствии с рекомендациями, при условии наличия в клинике препаратов
9.
В случае развития осложнений химиотерапии, лечение осложнений проводилось в соответствии с рекомендациями при условии наличия в клинике препаратов
10.
Если пациенту проводится 46-часовая инфузия 5-фторурацила, она проводилась через центральный венозный доступ
11.
Наличие назначений обследования перед хирургическим лечением в соответствии с рекомендациями
12.
Выполнение хирургического лечения в объеме, соответствующем указанным в рекомендациях
13.
Выполнение анестезии в соответствии с объемом оперативного вмешательства и тяжестью состояния пациента
14.
Отсутствие незапланированной интраоперационной травмы соседних органов (магистральных сосудов, мочеточников, мочевого пузыря, селезенки, тонкой кишки)
15.
Выполнено морфологическое и/или иммуногистохимическое исследование препарата удаленных тканей (при хирургическом вмешательстве)
16.
Проведена профилактика инфекционных осложнений антибактериальными лекарственными препаратами при хирургическом вмешательстве (при отсутствии медицинских противопоказаний)
17.
Выполнение тромбопрофилактики послеоперационных осложнений при условии отсутствия противопоказаний к ее проведению
18.
Отсутствие кровотечения в раннем послеоперационном периоде
19.
Отсутствие незапланированного инородного тела в области операционного поля
20.
Начат первый курс химиотерапии не позднее 30 дней от момента выявления метастатической болезни (при наличии медицинских показаний и отсутствии медицинских противопоказаний)
21.
Выполнен первый курс адъювантной химиотерапии не позднее 60 дней от момента хирургического вмешательства (при проведении адъювантной химиотерапии и отсутствии медицинских противопоказаний)
22.
Выполнение хирургического лечения в течение 14 дней с момента госпитализации (перевода) в хирургическое отделение (в случае если состояние больного тяжелое ECOG 3 - 4, этот период мог быть увеличен до 28 дней)
23
Больным раком прямой кишки со стадией cT3-4Т0-2M0 или cT2N1-2M0 и локализацией опухоли до 10 см от переходной анальной складки включительно выполнена предоперационная лучевая или химиолучевая терапии в соответствии с рекомендациями
24
Отсутствие перерывов при проведении предоперационной химиолучевой терапии
25
Выполнена колоноскопия тотальная или ирригоскопия при невозможности выполнения тотальной колоноскопии или компьютерно-томографическая колоноскопия при невозможности выполнения тотальной колоноскопии (при установлении диагноза)
26
Выполнена ректороманоскопия при раке прямой кишки или ректосигмоидного отдела (при установлении диагноза)
27
Выполнена биопсия опухоли толстой и/или прямой кишки при проведении колоноскопии и/или ректороманоскопии с последующим морфологическим и/или иммуногистохимическим исследованием (при установлении диагноза)
28
Выполнено ультразвуковое исследование органов брюшной полости (комплексное) и забрюшинного пространства и/или компьютерная томография органов брюшной полости и/или магнитно-резонансная томография органов брюшной полости (при установлении диагноза)
29
Выполнено ультразвуковое исследование органов малого таза и/или компьютерная томография органов малого таза и/или магнитно-резонансная томография органов малого таза (при установлении диагноза)
30
Выполнена рентгенография органов грудной клетки и/или компьютерная томография органов грудной клетки (при установлении диагноза)
31
Выполнено исследование уровня CA-19-9 и раковоэмбрионального антигена в крови (при установлении диагноза)
32
Выполнена химиотерапия и/или гормонотерапия и/или таргетная терапия и/или лучевая терапия при наличии морфологической верификации диагноза (при химиотерапии и/или гормонотерапии и/или таргетной терапии и/или лучевой терапии)
33
Выполнена дозиметрическая верификация рассчитанного плана (при лучевой терапии)
34
Выполнен общий (клинический) анализ крови развернутый не более, чем за 5 дней до начала курса химиотерапии и/или таргетной терапии и/или лучевой терапии
Список литературы
1. ![]() , J.; Grivennikov, S.; Karin, E.; Karin, M. Inflammation and colon cancer. Gastroenterology 2010, 138, 2101 - 2114
, J.; Grivennikov, S.; Karin, E.; Karin, M. Inflammation and colon cancer. Gastroenterology 2010, 138, 2101 - 2114
2. Johns, L.E.; Houlston, R.S. A systematic review and meta-analysis of familial colorectal cancer risk. Am. J. Gastroenterol. 2001, 96, 2992 - 3003.
3. Tenesa, A.; Dunlop, M.G. New insights into the aetiology of colorectal cancer from genome-wide association studies. Nat. Rev. Genet. 2009, 10, 353 - 358.
4. Huxley, R.R.; Ansary-Moghaddam, A.; Clifton, P.; Czernichow, S.; Parr, C.L.; Woodward, M. The impact of dietary and lifestyle risk factors on risk of colorectal cancer: A quantitative overview of the epidemiological evidence. Int. J. Cancer 2009, 125, 171 - 180.
5. Watson, A.J.M.; Collins, P.D. Colon cancer: A civilization disorder. Dig. Dis. 2011, 29, 222 - 228.
6. Meyerhardt, J.A.; Catalano, P.J.; Haller, D.G.; Mayer, R.J.; Macdonald, J.S.; Benson, A.B.; Fuchs, C.S. Impact of diabetes mellitus on outcomes in patients with colon cancer. J. Clin. Oncol. 2003, 21, 433 - 440.
7. Hjartaker A. et al. Subsite-specific dietary risk factors for colorectal cancer: a review of cohort studies. J Oncol 2013, Article ID 703854, 14 pages (2013).
8. Theodoratou E. et al. Associations between dietary and lifestyle risk factors and colorectal cancer in the Scottish population. Eur J Cancer Prev 23, 8 - 17 (2014).
9. Rasool S., Kadla S.A., Rasool V. & Ganai B.A. A comparative overview of general risk factors associated with the incidence of colorectal cancer. Tumor Biol 34, 2469 - 2476 (2013).
10. Esposito K. et al. Colorectal cancer association with metabolic syndrome and its components: A systematic review with meta-analysis. Endocrine 44, 634 - 647 (2013).
11. Larsson S.C., Orsini N. & Wolk A. Diabetes mellitus and risk of colorectal cancer: a meta-analysis. J Natl Cancer Inst 97, 1679 - 1687 (2005)
12. Raskov H., Pommergaard H.C., Burcharth J. & Rosenberg J. Colorectal carcinogenesis--update and perspectives. World J Gastroentero 20, 18151 - 18164 (2014)
13. Donohoe C, O'farrell N, Doyle S, Reynolds J (2014). The role of obesity in gastrointestinal cancer: evidence and opinion. Therap Adv Gastroenterol, 7, 38 - 50.
14. Давыдов М.И., Аксель Е.М. Статистика злокачественных новообразований в России и странах СНГ в 2014 г.//Издательская группа РОНЦ. 2016. - 217 С.
15. Finan PJ, Ritchie JK, Hawley PR. Synchronous and "early" metachronous carcinomas of the colon and rectum. Br J Surg 1987; 74: 945 - 47.
16. Barillari P, Ramacciato G, De Angelis R et al. Effect of preoperative colonoscopy on the incidence of synchronous and metachronous neoplasms, Acta Chir Scand 1990; 156: 163 - 166
17. Computed tomographic colonography compared with colonoscopy or barium enema for diagnosis of colorectal cancer in older symptomatic patients: two multicentre randomised trials with economic evaluation (the SIGGAR trials). Health Technol Assess. 2015 Jul; 19 (54): 1 - 134. (https://www.ncbi.nlm.nih.gov/pubmed/26198205)
18. Starck M, Bohe M, Simanaitis M, Valentin L. Rectal endosonography can distinguish benign rectal lesions from invasive early rectal cancers. Colorectal Dis. 2003 May; (3): 246 - 50. (https://www.ncbi.nlm.nih.gov/pubmed/26198205)
Niekel MC, Bipat S, Stoker J, et al. Diagnostic imaging of colorectal liver metastases with CT, MR imaging, FDG PET, and/or FDG PET/CT: a meta-analysis of prospective studies including patients who have not previously undergone treatment. Radiology. 2010 Dec; 257 (3): 674 - 84. (https://www.ncbi.nlm.nih.gov/pubmed/26198205)
20. Lee EJ, Lee JB, Lee SH, et al. (https://www.ncbi.nlm.nih.gov/pubmed/26198205) Endoscopic submucosal dissection for colorectal tumors--1,000 colorectal ESD cases: one specialized institute"s experiences. Surg Endosc. 2013 Jan; 27 (1): 31 - 9. (https://www.ncbi.nlm.nih.gov/pubmed/22729707/)
21. Федянин М.Ю., Трякин А.А., Тюляндин С.А. Адъювантная химиотерапия рака толстой кишки.//Фарматека N 7(220) 2011, с. 21 - 27. (https://www.ncbi.nlm.nih.gov/pubmed/22729707/)
22. Hughes KS, Simon R, Songhorabodi S, et al. Resection of the liver for colorectal carcinoma metastases: a multi-institutional study of patterns of recurrence. Surgery. 1986 Aug; 100 (2): 278 - 84. (https://www.ncbi.nlm.nih.gov/pubmed/22729707/)
23. Oshowo A, Gillams A, Harrison E, et al. Comparison of resection and radiofrequency ablation for treatment of solitary colorectal liver metastases. Br J Surg. 2003 Oct; 90(10): 1240-3 (https://www.ncbi.nlm.nih.gov/pubmed/22729707/)
24. Falcone A., Cremolini C., Masi G., et al. FOLFOXIRI/bevacizumab (bev) versus FOLFIRI/bev as first-line treatment in unresectable metastatic colorectal cancer (mCRC) patients (pts): Results of the phase III TRIBE trial by GONO group. J Clin Oncol. 31, 2013 (suppl; abstr 3505). (https://www.ncbi.nlm.nih.gov/pubmed/22729707/)
25. Федянин М.Ю., Трякин А.А., Тюляндин С.А. Потенциальные предикторы эффективности анти-EGFR-терапии при метастатическом раке толстой кишки.//Онкологическая колопроктология 2013, N 2, стр. 21 - 30. (https://www.ncbi.nlm.nih.gov/pubmed/22729707/)
26. Landmann RG, (http://www.ncbi.nlm.nih.gov/pubmed?term=) Weiser MR. (http://www.ncbi.nlm.nih.gov/pubmed?term=) Clin Colon Rectal Surg. 2005 Aug; 18 (3): 182 - 9. Surgical management of locally advanced and locally recurrent colon cancer. (http://www.ncbi.nlm.nih.gov/pubmed/20011301)
27.  KF, Matos D,
KF, Matos D,  P. Cochrane Database Syst Rev. 2011 Sep 7; (9): CD001544. Epub 2011 Sep 7) (http://www.ncbi.nlm.nih.gov/pubmed/20011301)
P. Cochrane Database Syst Rev. 2011 Sep 7; (9): CD001544. Epub 2011 Sep 7) (http://www.ncbi.nlm.nih.gov/pubmed/20011301)
28. van der Pas M. H. G. M. et al. Laparoscopic versus open surgery for rectal cancer (COLOR II): short-term outcomes of a randomised, phase 3 trial//The lancet oncology. - 2013. - T. 14. - N. 3. - C. 210 - 218. (http://www.ncbi.nlm.nih.gov/pubmed/20011301)
29. Kang S. B. et al. Open versus laparoscopic surgery for mid or low rectal cancer after neoadjuvant chemoradiotherapy (COREAN trial): short-term outcomes of an open-label randomised controlled trial //The lancet oncology. - 2010. - T. 11. - N. 7. - C. 637 - 645. (http://www.ncbi.nlm.nih.gov/pubmed/20011301)
30. Jeong S. Y. et al. Open versus laparoscopic surgery for mid-rectal or low-rectal cancer after neoadjuvant chemoradiotherapy (COREAN trial): survival outcomes of an open-label, non-inferiority, randomised controlled trial//The Lancet Oncology. - 2014. - T. 15. - N. 7. - C. 767 - 774. (http://www.ncbi.nlm.nih.gov/pubmed/20011301)
31. Green B. L. et al. Long-term follow-up of the Medical Research Council CLASICC trial of conventional versus laparoscopically assisted resection in colorectal cancer //British Journal of Surgery. - 2013. - T. 100. - N. 1. - C. 75 - 82. (http://www.ncbi.nlm.nih.gov/pubmed/20011301)
32. De Salvo GL, Gava C, Lise M et al. Curative surgery for obstruction from primary left colorectal carcinoma: Primary or staged resection. The Cochrane Database of Systematic Reviews 2006 Issue 2 (http://www.ncbi.nlm.nih.gov/pubmed/20011301)
33. Khot UP, Lang AW, Murali K, Parker MC. Systematic review of the efficacy and safety of colorectal stents. Br J Surg 2002; 89 (9): 1096 - 1020. (http://www.ncbi.nlm.nih.gov/pubmed/20011301)
34. Meyer F, Marusch F, Coch A, Meyer L, Fuhrer S, Kockerling F, et al. the German Study Group 'Colorectal Carcinoma (Primary Tumor)' Emergency operation in carcinomas of the left colon: value of Hartmann"s procedure. Tech Coloproctol. 2004; 8: S226 - 9 (http://www.ncbi.nlm.nih.gov/pubmed/20011301)
35. Seymour MT, Maughan TS, Ledermann JA et al. Different strategies of sequential and combination chemotherapy for patients with poor prognosis advanced colorectal cancer (MRC FOCUS): a randomised controlled trial. Lancet 2007; 370: 143 - 152. (http://www.ncbi.nlm.nih.gov/pubmed/20011301)
36. Cunningham D, Sirohi B, Pluzanska A et al. Two different first-line 5-fluorouracil regimens with or without oxaliplatin in patients with metastatic colorectal cancer. Ann Oncol 2009; 20: 244 - 250. (http://www.ncbi.nlm.nih.gov/pubmed/20011301)
37. Ackland SP, Jones M, Tu D et al. A meta-analysis of two randomised trials of early chemotherapy in asymptomatic metastatic colorectal cancer. Br J Cancer 2005; 93: 1236 - 1243 (http://www.ncbi.nlm.nih.gov/pubmed/20011301)
38. Schmoll HJ, Van Cutsem E, Stein A et al. ESMO consensus guidelines for management of patients with colon and rectal cancer. A personalized approach to clinical decision making. Ann Oncol 2012; 23: 2479 - 2516. (http://www.ncbi.nlm.nih.gov/pubmed/20011301)
39. Tournigand C, Andre T, Achille E et al. FOLFIRI followed by FOLFOX6 or the reverse sequence in advanced colorectal cancer: a randomized GERCOR study. J Clin Oncol 2004; 22: 229 - 237. (http://www.ncbi.nlm.nih.gov/pubmed/20011301)
40. Rosa B, (https://www.ncbi.nlm.nih.gov/pubmed/?term=Rosa%20B%5BAuthor%5D&cauthor=true&cauthor_uid=26557880) de Jesus JP, (https://www.ncbi.nlm.nih.gov/pubmed/?term=de%20Jesus%20JP%5BAuthor%5D&cauthor=true&cauthor_uid=26557880) de Mello EL, et al. Effectiveness and safety of monoclonal antibodies for metastatic colorectal cancer treatment: systematic review and meta-analysis, (https://www.ncbi.nlm.nih.gov/pubmed/?term=de%20Mello%20EL%5BAuthor%5D&cauthor=true&cauthor_uid=26557880) Ecancermedicalscience. 2015 Oct 15; 9: 582. (https://www.ncbi.nlm.nih.gov/pubmed/26557880)
41. Bayraktar B, Ozemir IA, Kefeli U, et al. (https://www.ncbi.nlm.nih.gov/pubmed/26557880) Colorectal stenting for palliation and as a bridge to surgery: A 5-year follow-up study. World J Gastroenterol. 2015 Aug 21; 21 (31): 9373 - 9. (https://www.ncbi.nlm.nih.gov/pubmed/26309363)
42. Glynne-Jones R., Tan D., Goh V. Pelvic MRI for guiding treatment decisions in rectal cancer//Oncology. - 2014. - T. 28. - N. 8. - C. 667 - 667. (https://www.ncbi.nlm.nih.gov/pubmed/26309363)
43. Brown G. et al. Preoperative assessment of prognostic factors in rectal cancer using high-resolution magnetic resonance imaging//British Journal of Surgery. - 2003. - T. 90. - N. 3. - C. 355 - 364. (https://www.ncbi.nlm.nih.gov/pubmed/26309363)
44. Lee J. H. et al. Prediction of pathologic staging with magnetic resonance imaging after preoperative chemoradiotherapy in rectal cancer: pooled analysis of KROG 10-01 and 11-02//Radiotherapy and Oncology. - 2014. - T. 113. - N. 1. - C. 18 - 23. (https://www.ncbi.nlm.nih.gov/pubmed/26309363)
45. Algebally A. M. et al. The Value of High-Resolution MRI Technique in Patients with Rectal Carcinoma: Pre-Operative Assessment of Mesorectal Fascia Involvement, Circumferential Resection Margin and Local Staging//Polish Journal of Radiology. - 2015. - T. 80. - C. 115. (https://www.ncbi.nlm.nih.gov/pubmed/26309363)
46. Vliegen R. F. A. et al. Rectal Cancer: MR Imaging in Local Staging - Is Gadolinium-based Contrast Material Helpful? 1//Radiology. - 2005. - T. 234. - N. 1. - C. 179 - 188. (https://www.ncbi.nlm.nih.gov/pubmed/26309363)
47. Glimelius B. et al. Rectal cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up //Annals of oncology. - 2013. - T. 24. - N. suppl 6. - C. vi81 - vi88. (https://www.ncbi.nlm.nih.gov/pubmed/26309363)
48. Nascimbeni R. et al. Long-term survival after local excision for T1 carcinoma of the rectum//Diseases of the colon & rectum. - 2004. - T. 47. - N. 11. - C. 1773 - 1779. (https://www.ncbi.nlm.nih.gov/pubmed/26309363)
49. Sgourakis G. et al. Transanal endoscopic microsurgery for T1 and T2 rectal cancers: a meta-analysis and meta-regression analysis of outcomes//The American surgeon. - 2011. - T. 77. - N. 6. - C. 761 - 772. (https://www.ncbi.nlm.nih.gov/pubmed/26309363)
50. Doornebosch P. G., Tollenaar R., de Graaf E. J. R. Is the increasing role of transanal endoscopic microsurgery in curation for T1 rectal cancer justified?//PG Doornebosch. - C. 9. (https://www.ncbi.nlm.nih.gov/pubmed/26309363)
51. Wong R. K. S. et al. Pre-operative radiotherapy and curative surgery for the management of localized rectal carcinoma//The Cochrane Library. - 2007. (https://www.ncbi.nlm.nih.gov/pubmed/26309363)
52. Mathis K. L. et al. Unresectable colorectal cancer can be cured with multimodality therapy //Annals of surgery. - 2008. - T. 248. - N. 4. - C. 592 - 598. (https://www.ncbi.nlm.nih.gov/pubmed/26309363)
53. Yin Z. et al. Timing of hepatectomy in resectable synchronous colorectal liver metastases (SCRLM): Simultaneous or delayed?//Hepatology. - 2013. - T. 57. - N. 6. - C. 2346 - 2357. (https://www.ncbi.nlm.nih.gov/pubmed/26309363)
54. Feng O. et al. Timing of Hepatectomy for Resectable Synchronous Colorectal Liver Metastases: For Whom Simultaneous Resection Is More Suitable-A Meta-Analysis//PLoS one. - 2014. - T. 9. - N. 8. - C. e 104348. (https://www.ncbi.nlm.nih.gov/pubmed/26309363)
55. Garden O. J. et al. Guidelines for resection of colorectal cancer liver metastases//Gut. - 2006. - T. 55. - N. suppl 3. - C. iii1 - iii8. (https://www.ncbi.nlm.nih.gov/pubmed/26309363)
56.  K. F., Matos D.,
K. F., Matos D.,  P. Mechanical bowel preparation for elective colorectal surgery//The Cochrane Library. - 2011. (https://www.ncbi.nlm.nih.gov/pubmed/26309363)
P. Mechanical bowel preparation for elective colorectal surgery//The Cochrane Library. - 2011. (https://www.ncbi.nlm.nih.gov/pubmed/26309363)
57. Heald R. J. et al. Rectal cancer: the Basingstoke experience of total mesorectal excision, 1978 - 1997//Archives of Surgery. - 1998. - T. 133. - N. 8. - C. 894 - 898. (https://www.ncbi.nlm.nih.gov/pubmed/26309363)
58. Havenga K. et al. Anatomical basis of autonomic nerve-preserving total mesorectal excision for rectal cancer//British journal of surgery. - 1996. - T. 83. - N. 3. - C. 384 - 388. (https://www.ncbi.nlm.nih.gov/pubmed/26309363)
59. Martin S.T., Heneghan H.M., Winter D.C. Systematic review and meta-analysis of outcomes following pathological complete response to neoadjuvant chemoradiotherapy for rectal cancer//British Journal of Surgery. - 2012. - T. 99. - N. 7. - C. 918 - 928. (https://www.ncbi.nlm.nih.gov/pubmed/26309363)
60. Ceelen W. P., Van Nieuwenhove Y., Fierens K. Preoperative chemoradiation versus radiation alone for stage II and III resectable rectal cancer//The Cochrane Library. - 2009. (https://www.ncbi.nlm.nih.gov/pubmed/26309363)
61. Stornes T, Wibe A, Nesbakken A et al. National early rectal cancer treatment revisited. Dis Colon Rectum 2016; 59: 623 - 629 (https://www.ncbi.nlm.nih.gov/pubmed/26309363)
62. MERCURY Study Group. Diagnostic accuracy of preoperative magnetic resonance imaging in predicting curative resection of rectal cancer: prospective observational study. BMJ. 2006; 333: 779 (https://www.ncbi.nlm.nih.gov/pubmed/26309363)
63. Jonker DJ, Maroun JA, Kocha W. Survival benefit of chemotherapy in metastatic colorectal cancer: a meta-analysis of randomized controlled trials. British journal of cancer. 2000 Jun; 82 (11): 1789. (https://www.ncbi.nlm.nih.gov/pubmed/26309363)
64. Kanas GP, Taylor A, Primrose JN, Langeberg WJ, Kelsh MA, Mowat FS, Alexander DD, Choti MA, Poston G. Survival after liver resection in metastatic colorectal cancer: review and meta-analysis of prognostic factors. Clinical epidemiology. 2012; 4: 283. (https://www.ncbi.nlm.nih.gov/pubmed/26309363)
65. Brandi G, De Lorenzo S, Nannini M, Curti S, Ottone M, DalPOlio FG, Barbera MA, Pantaleo MA, Biasco G. Adjuvant chemotherapy for resected colorectal cancer metastases: Literature review and meta-analysis. World journal of gastroenterology. 2016 Jan 14; 22 (2): 519. (https://www.ncbi.nlm.nih.gov/pubmed/26309363)
66. Chua TC, Saxena A, Liauw W, Kokandi A, Morris DL. Systematic review of randomized and nonrandomized trials of the clinical response and outcomes of neoadjuvant systemic chemotherapy for resectable colorectal liver metastases. Annals of surgical oncology. 2010 Feb 1; 17 (2): 492 - 501. (https://www.ncbi.nlm.nih.gov/pubmed/26309363)
67. Primrose J, Falk S, Finch-Jones M, Valle J, O"Reilly D, Siriwardena A, Hornbuckle J, Peterson M, Rees M, Iveson T, Hickish T. Systemic chemotherapy with or without cetuximab in patients with resectable colorectal liver metastasis: the New EPOC randomised controlled trial. The lancet oncology. 2014 May 1; 15 (6): 601 - 11. (https://www.ncbi.nlm.nih.gov/pubmed/26309363)
68. Alberts SR, Sargent DJ, Nair S, et al: Effect of oxaliplatin, fluorouracil, and leucovorin with or without cetuximab on survival among patients with resected stage III colon cancer: A randomized trial. JAMA 307: 1383 - 1393, 2012 (https://www.ncbi.nlm.nih.gov/pubmed/26309363)
69. Allegra CJ, Yothers G, O'Connell MJ, et al: Bevacizumab in stage II - III colon cancer: 5-year update of the National Surgical Adjuvant Breast and Bowel Project C-08 trial. J Clin Oncol 31: 359 - 364, 2013 (https://www.ncbi.nlm.nih.gov/pubmed/26309363)
70. Jonker D, Rumble RB, Maroun J, Gastrointestinal Cancer Disease Site Groupof Cancer Care Ontario's Program in Evidence-Based Care. Role of oxaliplatin combined with 5-fluorouracil and folinic acid in the first-and second-line treatment of advanced colorectal cancer. Current Oncology. 2006 Oct; 13 (5): 173. (https://www.ncbi.nlm.nih.gov/pubmed/26309363)
71. Teixeira MC, Marques DF, Ferrari AC, Alves MF, Alex AK, Sabbaga J, Hoff PM, Riechelmann RP. The effects of palliative chemotherapy in metastatic colorectal cancer patients with an ECOG performance status of 3 and 4. Clinical colorectal cancer. 2015 Mar 1; 14 (1): 52 - 7. (https://www.ncbi.nlm.nih.gov/pubmed/26309363)
72. Cameron MG, Kersten C, Vistad I, van Helvoirt R, Weyde K, Undseth C, Mjaaland I, Skovlund E, ![]() SD, Guren MG. Palliative pelvic radiotherapy for symptomatic rectal cancer-a prospective multicenter study. Acta Oncologica. 2016 Dec 1; 55 (12): 1400 - 7. (https://www.ncbi.nlm.nih.gov/pubmed/26309363)
SD, Guren MG. Palliative pelvic radiotherapy for symptomatic rectal cancer-a prospective multicenter study. Acta Oncologica. 2016 Dec 1; 55 (12): 1400 - 7. (https://www.ncbi.nlm.nih.gov/pubmed/26309363)
73. Lee CW, Bociek G, Faught W. A survey of practice in management of malignant ascites. J Pain Symptom Manage. 1998; 16: 96 - 101 (https://www.ncbi.nlm.nih.gov/pubmed/26309363)
Приложение А1
СОСТАВ РАБОЧЕЙ ГРУППЫ
1. Ананьев В.С., профессор, д.м.н., ведущий научный сотрудник отделения хирургического N 3 проктологическое ФГБУ "Российский онкологический научный центр им. Н.Н. Блохина" Минздрава России;
2. Артамонова Е.В., д.м.н., ведущий научный сотрудник отделения амбулаторной химиотерапии (дневной стационар) ФГБУ "Российский онкологический научный центр им. Н.Н. Блохина" Минздрава России;
3. Ачкасов С.И., профессор, д.м.н., руководитель отдела онкологии и хирургии ободочной кишки ФГБУ "Государственный научный центр колопроктологии им. А.Н. Рыжих" Минздрава России;
4. Барсуков Ю.А., профессор, д.м.н., главный научный сотрудник отделения хирургического N 3 проктологическое ФГБУ "Российский онкологический научный центр им. Н.Н. Блохина" Минздрава России;
5. Гордеев С.С., к.м.н., врач-онколог отделения хирургического N 3 проктологическое ФГБУ "Российский онкологический научный центр им. Н.Н. Блохина" Минздрава России;
6. Карачун А.М., профессор, д.м.н. заведующий хирургическим отделением абдоминальной онкологии (http://oncodepartment.ru) ФГБУ "НИИ онкологии им. Н.Н. Петрова" Минздрава России (http://niioncologii.ru). сотрудник кафедры онкологии Северо-Западного государственного медицинского университета им. И.И. Мечникова;
7. Личиницер М.Р., академик РАН, профессор, д.м.н., заведующий отделением химиотерапии и комбинированного лечения злокачественных опухолей ФГБУ "Российский онкологический научный центр им. Н.Н. Блохина" Минздрава России;
8. Расулов А.О., д.м.н., заведующий отделения хирургического N 3 проктологическое ФГБУ "Российский онкологический научный центр им. Н.Н. Блохина" Минздрава России;
9. Сагайдак И.В., профессор, д.м.н., главный научный сотрудник отделения хирургического N 7 опухолей печени и поджелудочной железы ФГБУ "Российский онкологический научный центр им. Н.Н. Блохина" Минздрава России;
10. Сидоров Д.В., д.м.н., руководитель абдоминального отделения Московского научно-исследовательского онкологического института имени П.А. Герцена - филиал ФГБУ "НМИРЦ" Минздрава России;
11. Трякин А.А., д.м.н., старший научный сотрудник отделения клинической фармакологии и химиотерапии ФГБУ "Российский онкологический научный центр им. Н.Н. Блохина" Минздрава России;
12. Федянин М.Ю., к.м.н., старший научный сотрудник отделения клинической фармакологии и химиотерапии ФГБУ "Российский онкологический научный центр им. Н.Н. Блохина" Минздрава России;
13. Шелыгин Ю.А. академик РАН, профессор, д.м.н., президент Общероссийской общественной некоммерческой организации "Ассоциация колопроктологов России", директор ФГБУ "ГНЦК им. А.Н. Рыжих" Минздрава России, главный внештатный специалист колопроктолог Министерства здравоохранения РФ.
Конфликта интересов нет
Приложение А2
МЕТОДОЛОГИЯ РАЗРАБОТКИ КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ
Целевая аудитория данных клинических рекомендаций:
1. Врачи-онкологи;
2. Врачи-хирурги;
3. Врачи-радиологи;
4. Врачи-химиотерапевты;
5. Врачи-генетики;
6. Студенты медицинских ВУЗов, ординаторы и аспиранты.
Методы, использованные для сбора/селекции доказательств: поиск в электронных базах данных; анализ современных научных разработок по проблеме РБ в РФ и за рубежом; обобщение практического опыта российских и зарубежных специалистов.
Таблица П1 - Уровни достоверности доказательств в соответствии с классификацией Агентства по политике медицинского обслуживания и исследований (AHCPR, 1992)
Уровни достоверности доказательств
Описание
Ia
Доказательность, основанная на мета-анализе рандомизированных контролируемых исследований
Ib
Доказательность, основанная как минимум на одном рандомизированном контролируемом исследовании с хорошим дизайном
IIa
Доказательность, основанная как минимум на одном крупном нерандомизированном контролируемом исследовании
IIb
Доказательность, основанная как минимум на одном квазиэксперементальном исследовании с хорошим дизайном
III
Доказательность, основанная на неэкспериментальных описательных исследованиях с хорошим дизайном, типа сравнительных исследований, корреляционных исследований и исследований случай-контроль
IV
Доказательность, основанная на мнении экспертов, на опыте или мнении авторов
Таблица П2 - Уровни убедительности рекомендаций в соответствии с классификацией Агентства исследований и оценки качества медицинского обслуживания (AHRQ, 1994)
Уровень убедительности рекомендации
Уровни достоверности доказательств
Описание
A
Ia, Ib
Доказательность, основанная как минимум на одном рандомизированном контролируемом исследовании с хорошим дизайном
B
IIa, IIb, III
Доказательность, основанная на хорошо выполненных нерандомизированных клинических исследованиях
C
IV
Доказательность, основанная на мнении экспертов, на опыте или мнении авторов. Указывает на отсутствие исследований высокого качества
Методы, использованные для формулирования рекомендаций - консенсус экспертов.
Экономический анализ
Анализ стоимости не проводился и публикации по фармакоэкономике не анализировались.
Метод валидизации рекомендаций:
- Внешняя экспертная оценка
- Внутренняя экспертная оценка
Описание метода валидизации рекомендаций:
Настоящие рекомендации в предварительной версии рецензированы независимыми экспертами, которые попросили прокомментировать, прежде всего, насколько интерпретация доказательств, лежащих в основе рекомендаций, доступна для понимания.
Получены комментарии со стороны врачей-детских онкологов первичного звена в отношении доходчивости изложения рекомендаций и их оценки важности рекомендаций как рабочего инструмента повседневной практики.
Комментарии, полученные от экспертов, тщательно систематизировались и обсуждались председателем и членами рабочей группы. Каждый пункт обсуждался и вносимые в результате этого изменения в рекомендации регистрировались. Если же изменения не вносились, то регистрировались причины отказа от внесения изменений.
Консультации и экспертная оценка: Проект рекомендаций рецензирован также независимыми экспертами, которых попросили прокомментировать, прежде всего, доходчивость и точность интерпретации доказательной базы, лежащей в основе рекомендаций.
Для окончательной редакции и контроля качества рекомендации повторно проанализированы членами рабочей группы, которые пришли к заключению, что все замечания и комментарии экспертов приняты во внимание, риск систематических ошибок при разработке рекомендаций сведен к минимуму.
Обновления клинических рекомендаций: актуализация проводится не реже чем один раз в три года с учетом появившейся новой информации о диагностике и тактике ведения пациентов с РБ. Решение об обновлении принимает МЗ РФ на основе предложений, представленных медицинскими профессиональными некоммерческими организациями. Сформированные предложения должны учитывать результаты комплексной оценки лекарственных препаратов, медицинских изделий, а также результаты клинической апробации.
При отборе публикаций, как потенциальных источников доказательств, использованная в каждом исследовании методология изучается для того, чтобы убедиться в ее достоверности. Результат изучения влияет на уровень доказательств, присваиваемый публикации, что в свою очередь влияет на силу, вытекающих из нее рекомендаций.
Приложение А3
СВЯЗАННЫЕ ДОКУМЕНТЫ
Типовую стандартизированную схему ведения пациентов можно скачать здесь (http://democenter.nitrosbase.com/clinrecalg5/Files/TypicalSchemes/A-C20.zip)
КР400. Хронический болевой синдром (ХБС) у взрослых пациентов, нуждающихся в паллиативной медицинской помощи (http://cr.rosminzdrav.ru/#!/schema/708)
Приложение Б
АЛГОРИТМЫ ВЕДЕНИЯ ПАЦИЕНТА
Схема 1. Блок-схема диагностики и лечения больного раком прямой кишки
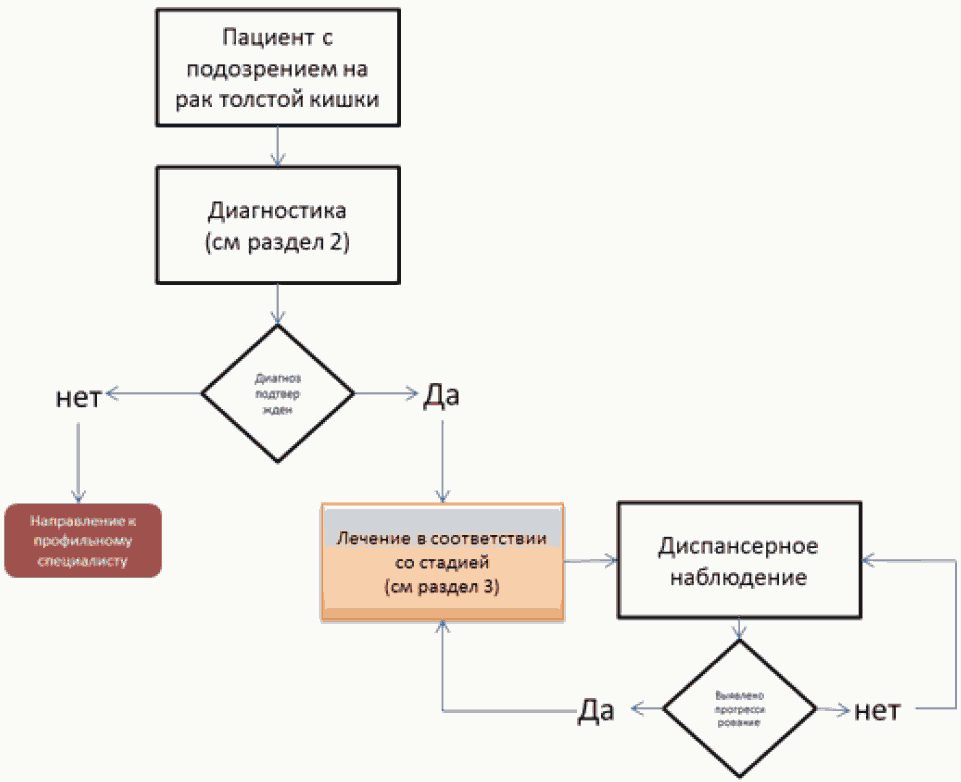
Приложение В
ИНФОРМАЦИЯ ДЛЯ ПАЦИЕНТОВ
Рекомендации при осложнениях химиотерапии - связаться с химиотерапевтом.
1) При повышении температуры тела 38 °C и выше:
- Начать прием антибиотиков: по рекомендации химиотерапевта
2) При стоматите:
- Диета - механическое, термическое щажение;
- Частое полоскание рта (каждый час) - ромашка, кора дуба, шалфей, смазывать рот облепиховым (персиковым) маслом;
- Обрабатывать полость рта по рекомендации химиотерапевта
3) При диарее:
- Диета - исключить жирное, острое, копченое, сладкое, молочное, клетчатку. Можно нежирное мясо, мучное, кисломолочное, рисовый отвар. Обильное питье.
- Принимать препараты по рекомендации химиотерапевта
4) При тошноте:
- Принимать препараты по рекомендации химиотерапевта
Приложение Г
Критерии Amsterdam I
1. По крайней мере у 3 родственников присутствует гистогически верифицированный колоректальный рак, один из них - родственник первой линии
2. Заболевание прослеживается по крайней мере в двух поколениях
3. По крайней мере у 1 из родственников колоректальный рак диагностирован в возрасте до 50 лет
4. Семейный аденоматозный полипоз исключен
Критерии Amsterdam II
1. По крайней мере у 3 родственников развился рак, связанный с синдромом Линча (КРР, рак эндометрия, рак желудка, яичников, мочеточника/почечной лоханки, головного мозга, тонкой кишки, гепатобилиарного тракта и кожи (сальных желез)), один из них - родственник первой линии
2. Заболевание прослеживается по крайней мере в двух поколениях
3. По крайней мере у 1 из родственников связанный с синдромом Линча рак диагностирован в возрасте до 50 лет
4. Семейный аденоматозный полипоз исключен в случаях наличия КРР
5. Опухоли по возможности должны быть верифицированы
Критерии Bethesda для тестирования на MSI (микросателлитную нестабильность)
1. Колоректальный рак у пациента младше 50 лет
2. Наличие синхронного, метахронного колоректального рака для другого рака, который может быть связан с синдромом Линча, вне зависимости от возраста
3. Колоректальный рак с выявленным при гистологическом исследовании высоком уровне микросателлитной нестабильности (MSI-H) у пациента в возрасте до 60 лет
4. Колоректальный рак у одного или более родственников первой линии с заболеванием, которое может быть связано с синдромом Линча, по крайней мере один из случаев заболевания выявлен в возрасте до 50 лет
5. Колоректальный рак у 2 или более родственников первой или второй линии с заболеваниями, которые могут быть связаны с синдромом Линча, вне зависимости от возраста.
